
Entropi 02 Pertidaksamaan Clausius dan hukum II Termodinamika YouTube
Hukum 3 termodinamika menyatakan bahwa entropi dari suatu kristal padatan saat suhu nol mutlak adalah nol. Hukum termodinamika ini membantu untuk menghitung entropi untuk dijadikan referensi yang disebut absolute entropy. Proses Termodinamika. Proses Isotermik. Proses ini terjadi saat suhu sistem tidak mengalami perubahan.

Persamaan Perubahan Entropi, Entalpi, Volume Spesifik dan Energi dalam YouTube
Entropi termodinamika mempunyai dimensi energi dibagi temperatur, yang mempunyai Satuan Internasional joule per kelvin (J/K). Kata entropi pertama kali dicetuskan oleh Rudolf Clausius pada tahun 1865, berasal dari bahasa Yunani εντροπία [entropía], εν- [en-] (masuk) dan τροπή [tropē] (mengubah, mengonversi). [2] [note 2]

Rumus Entropi Kimia Bit CDN
Hitam, dS adalah perubahan entropi hitam lubang, dan W a dalah kerja yang dilakukan pada L ubang .. Rumus suhu Lubang Hitam T = ħc 3 /8πGMk digunaka n untuk menyatakan suhu sebagai .

Pembahasan Latihan Soal No.5 Hukum Kedua Termodinamika Perubahan Entropi Fisika N20 YouTube
Video ini berisi penejelasan mengenai hukum termodinamika II dan Konsep Entropi. Contoh menghitung perubahan entropi dari suatu proses juga dibahas dalam vid.

Termodinamika (14) c prinsip_perubahan_entropi
Rumus Hukum Termodinamika 3. Rumus Hukum Termodinamika 3 dapat dinyatakan sebagai berikut: Saat suhu mutlak (T) mendekati nol (0 K atau -273.15 °C), entropi (S) dari suatu substansi murni mendekati nol (S → 0).. Jadi, perubahan entropi yang terjadi saat suhu material Z dinaikkan dari 350 K menjadi 450 K adalah sebesar 100 J/K.

menghitung perbandingan tekanan, suhu, usaha, kalor, perubahan energi dalam dan perubahan
Perubahan entropi selama proses kemudian ditentukan dengan mensubstitusi hubungan 𝑐_𝑣(T) atau 𝑐_𝑝(T) ini ke dalam Persamaan. 3 atau 4 dan melakukan integrasi. Alih-alih melakukan integral yang melelahkan ini setiap kali kita memiliki proses baru, akan lebih mudah untuk melakukan integral ini sekali dan mentabulasi hasilnya.

Perubahan Entalpi Pembakaran Standar Dan Contohnya Coretan
Dalam kimia, entropi molar standar adalah kandungan entropi dalam satu mol zat pada keadaan standar (bukan dalam STP).. Entropi molar standar biasanya disimbolkan dengan S°, dan dinyatakan dalam satuan joule per mol kelvin (J mol −1 K −1).Tidak seperti perubahan entalpi pembentukan, nilai S° bersifat absolut. Artinya, unsur dalam keadaan standar memiliki, nilai bukan nol yang pasti S.

PPT Energi, Entropi & Spontanitas Reaksi PowerPoint Presentation ID5926663
Termodinamika merupakan suatu ilmu yang menggambarkan usaha buat mengubah kalor (perpindahan energi yang disebabkan perbedaan suhu) jadi energi dan sifat-sifat pendukungnya. Termodinamika ini berhubungan erat dengan Fisika energi, panas, kerja, entropi dan kespontanan proses. Termodinamika juga berhubungan dengan mekanika statik.

Termodinamika Entropi Pada Gas Ideal YouTube
Entropi, Rumus, dan Contoh Soal Serta Jawabannya Entropi adalah suatu ukuran derajat ketidakteraturan suatu sistem termodinamika. Entropi merupakan sebuah konsep dalam ilmu kimia dan fisika yang juga termasuk ke dalam ilmu termodinamika kimia ataupun dalam kimia fisika. Konsep entropi ini penting untuk menjelaskan terjadinya perubahan dalam suatu sistem termodinamika.

Rumus Termodinamika Entropi Contoh Soal dan Jawaban
Rumus perubahan entropi adalah konsep penting dalam ilmu fisika dan kimia. Entropi sendiri didefinisikan sebagai ukuran ketidakteraturan atau kekacauan dalam sebuah sistem. Ketika sistem berubah, entropi dalam sistem tersebut juga berubah. Rumus perubahan entropi, atau ΔS, adalah perubahan entropi dalam sistem yang terjadi selama reaksi kimia atau perubahan fase. ΔS dapat dihitung dengan.

Contoh 3 Rumus Entropi dan Penjelasannya
Dalam fisika, rumus entropi dinyatakan sebagai ΔS = Q/T, di mana ΔS adalah perubahan entropi, Q adalah energi yang masuk atau keluar dari sistem, dan T adalah suhu sistem dalam Kelvin. Dalam matematika, rumus entropi dinyatakan sebagai S = k ln W, di mana S adalah entropi, k adalah konstanta Boltzmann, dan W adalah jumlah kemungkinan keadaan.
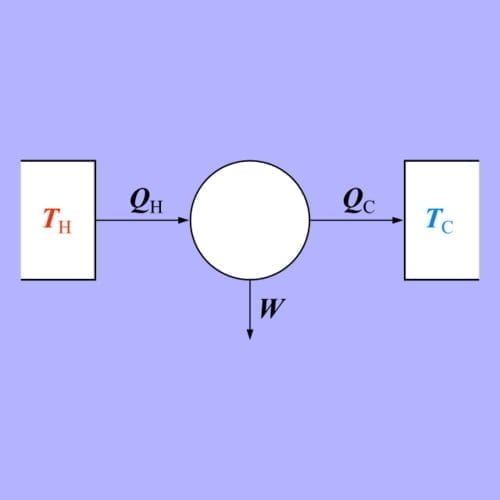
Entropi Hukum Ke2 Termodinamika Rumus, Contoh Soal dan Jawaban
Rumus perubahan entropi dapat diterapkan pada banyak aspek kehidupan sehari-hari, dan penting untuk dipahami agar kamu bisa memahami banyak konsep dalam ilmu fisika.Sampai jumpa kembali di artikel menarik lainnya! Laskar Berotak Update Terakhir Februari 7, 2023. 0 47 2 minutes read. Facebook Twitter Pinterest Messenger Messenger WhatsApp Telegram.

Termodinamika (14) c prinsip_perubahan_entropi
Termodinamika Adalah fisika energi, panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana hubungan termodinamika berasal. Temukan Rumus Termodinamika Entropi di bawah ini. Dalam bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan'. Pada sistem di mana terjadi proses perubahan wujud atau pertukaran energi, termodinamika.
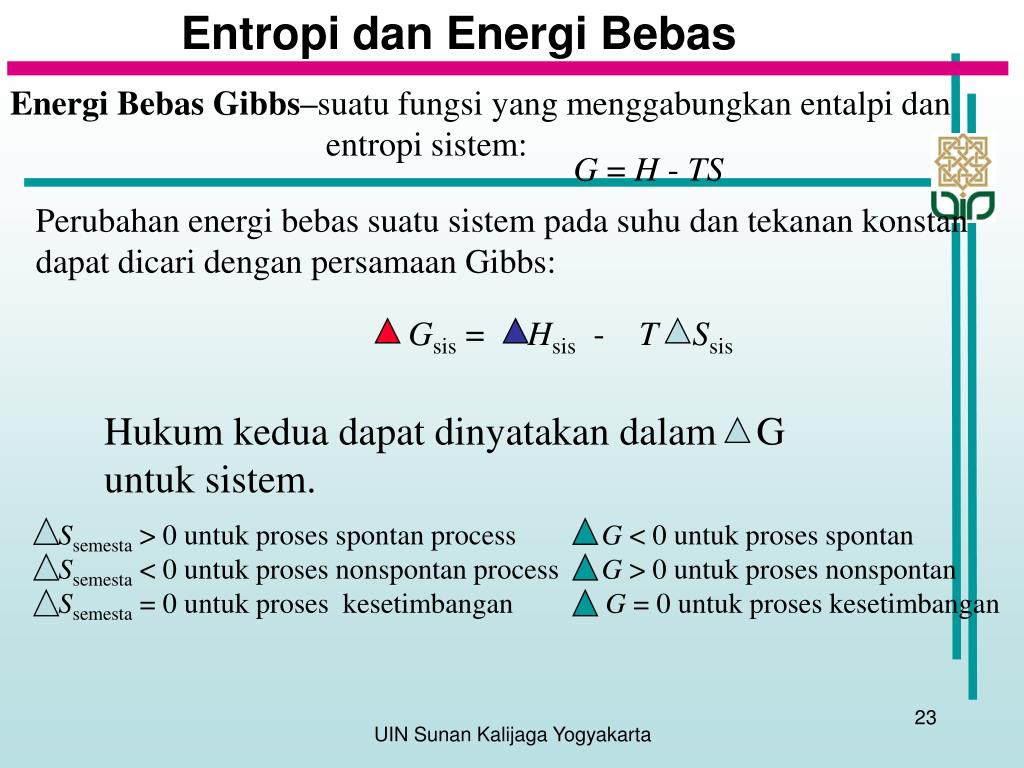
PPT Energi, Entropi & Spontanitas Reaksi PowerPoint Presentation ID5926663
Pada kegiatan belajar ini akan kita pelajari bagaimana entropi dan perubahan entropi dari suatu keadaan. Setelah mempelajari modul ini Anda diharapkan mampu menguraikan konsep entropi gas ideal dan perubahan entropi serta konsep azas entropi secara logis, kritis dan mandiri. Secara lebih khusus lagi, Anda diharapkan dapat: 1. menguraikan konsep.
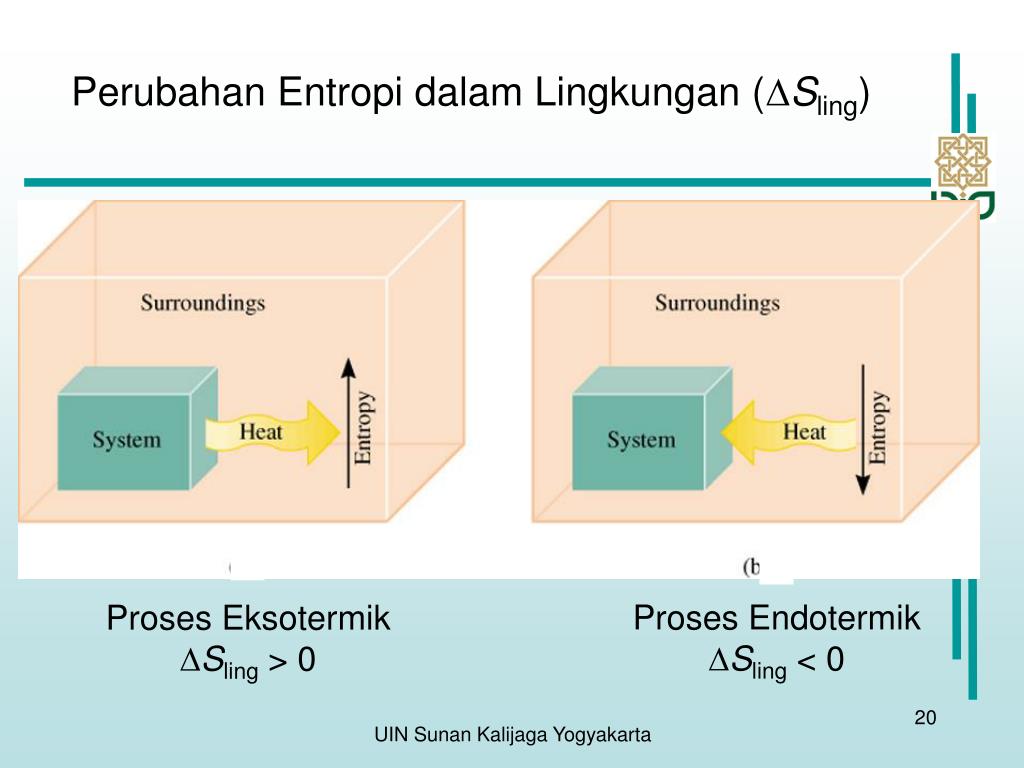
PPT Energi, Entropi & Spontanitas Reaksi PowerPoint Presentation ID5926663
Baca Juga Artikel Yang Mungkin Berhubungan : Hukum Newton 1, 2, 3 : Pengertian, Bunyi, Rumus dan Contoh Soal. Sebagaimana gambar sistem tertutup dibawah ini, jika panas diberikan kepada sistem (Qin), maka akan terjadi pengembangan pada zat yang berada didalam sistem. Pengembangan ini akan mengakibatkan piston akan terdorong ke atas (terjadi.
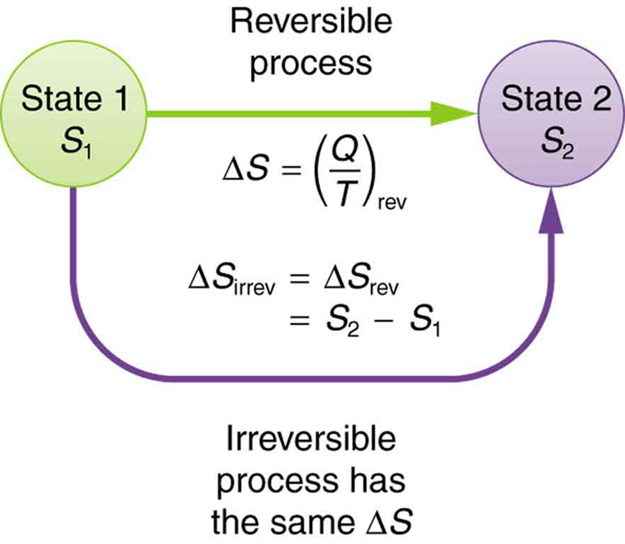
Entropy Boundless Physics
Rumus Entropi. Berikut beberapa cara untuk menghitung entropi: Proses Reversibel. Proses reversibel adalah proses yang dapat dibalik dan entropi dalam proses ini dapat dihitung dengan menggunakan rumus sebagai berikut: ΔS = kB ln(Wf/Wi) Keterangan: ΔS = perubahan entropi (J/K) kB = konstanta Boltzmann (1.38065 x 10^-23 J/K)