PERCOBAAN VIII REAKSI REDOKS (Kimia Dasar II) Blog Najih
Suatu reaksi dinyatakan sebagai reaksi redoks apabila terjadi pengurangan atau pemotongan. Reduktor. Pada reaksi redoks reduktor merupakan sebutan bagi senyawa yang bersifat reduktif atau memiliki kemampuan untuk mereduksi senyawa lain. Reduktor melepaskan atau memberikan elektron kepada senyawa lain alias mengalami oksidasi.
Contoh Soal Dan Pembahasan Reaksi Redoks
Reaksi ini bekerja dengan cara melepaskan dan mengikat oksigen. Jadi reaksi redoks adalah reaksi yang mempunyai dua peristiwa yakni melepaskan oksigen atau reduksi dan mengikat oksigen atau oksidasi. Konsep dari reaksi redoks adalah adanya perpindahan muatan negatif hanya pada senyawa ion dan tidak pada senyawa kovalen.

Reaksi Kimia Di Bawah Ini Yang Merupakan Reaksi Redoks Adalah Terbaru
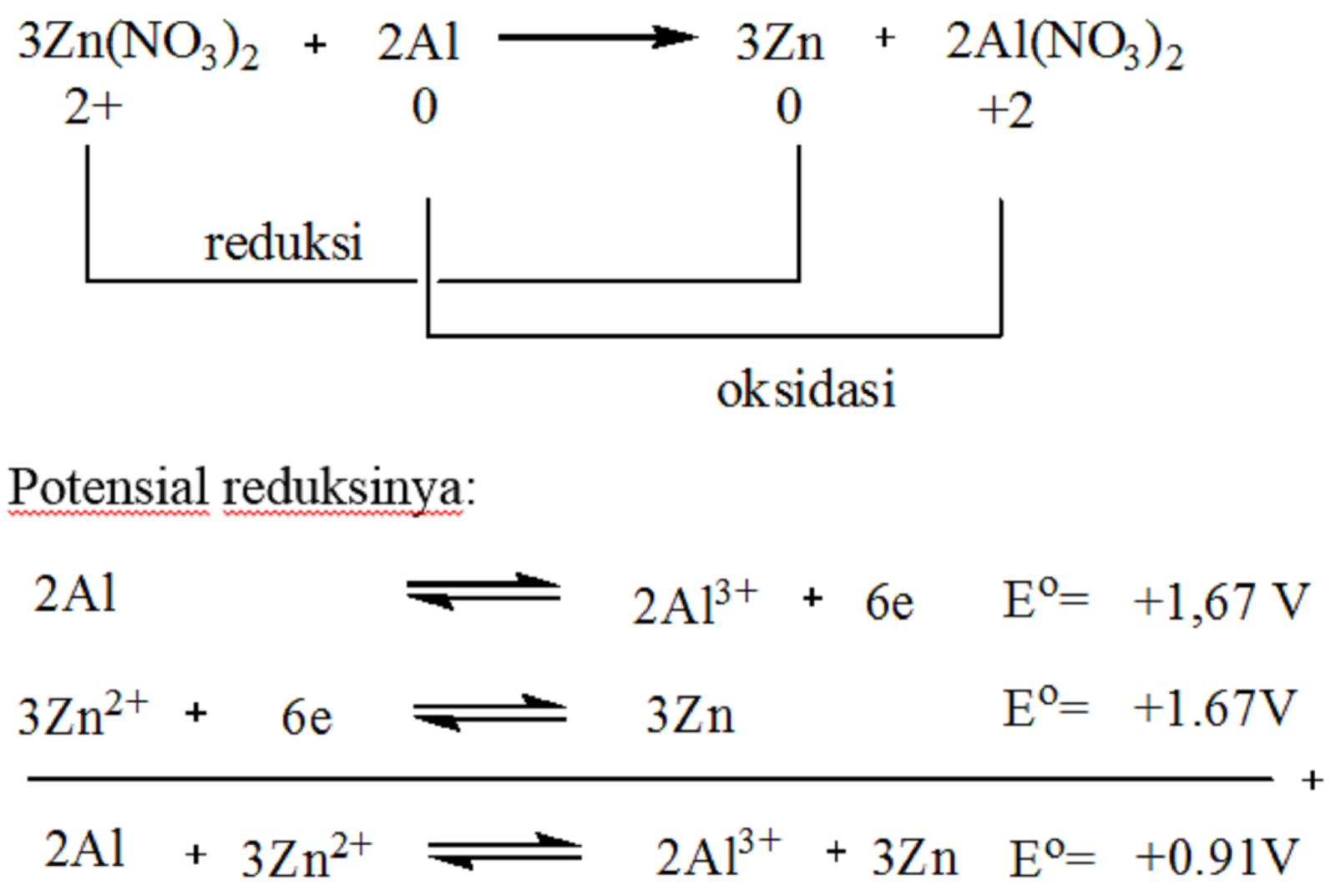
Pembahasan. Reaksi redoks merupakan reaksi reduksi dan oksidasi. Berdasarkan perubahan bilangan oksidasi, reduksi adalah peristiwa disertai penurunan biloks, sedangkan oksidasi adalah peristiwa disertai dengan kenaikan biloks . Pada reaksi. tidak terjadi perubahan bilangan oksidasi. Biloks Nitrogen tetap +5 dan biloks Oksigen tetap -2.

KONSEP DASAR REAKSI REDOKS YouTube
Perkaratan besi adalah reaksi redoks. Peristiwa perkaratan besi adalah hasil dari reaksi redoks (reduksi dan oksidasi) yang tidak diinginkan. Dilansir dari BBC, besi bereaksi dengan air dan oksigen untuk membentuk besi (III) oksida terhidrasi atau yang dikenal sebagai karat. Baca juga: Pengertian dan Proses Terjadinya Korosi.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10 Belajar Gratis di Rumah
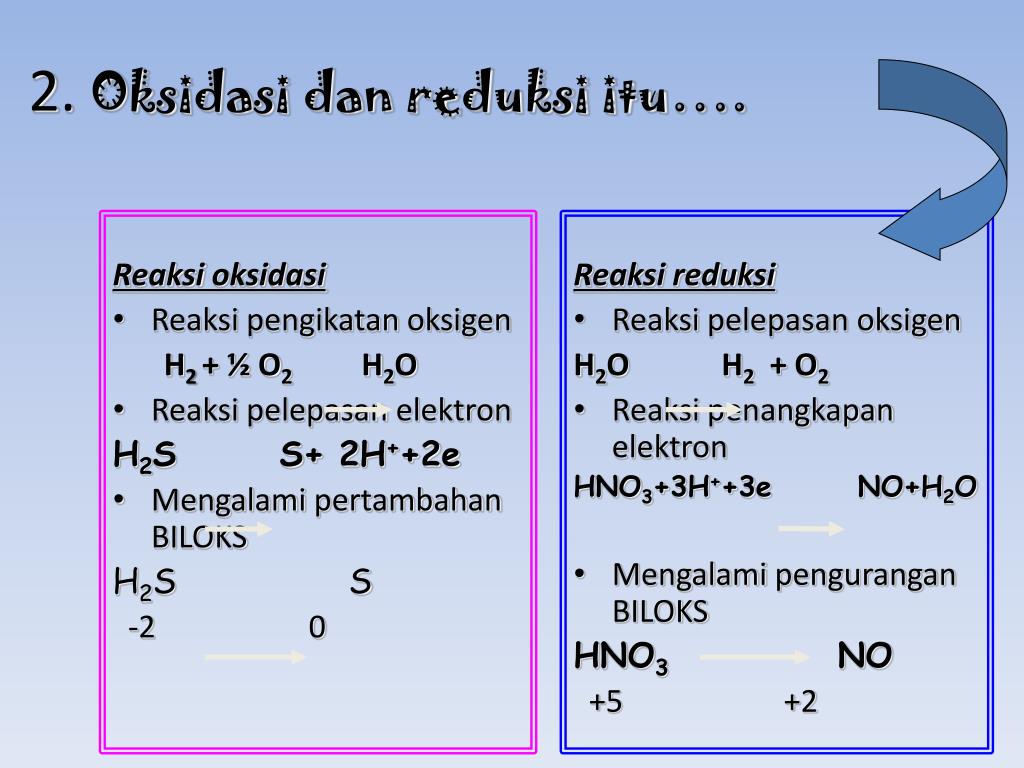
Konsep reaksi redoks yang melibatkan perpindahan elektron ini cuma dapat terjadi pada senyawa ionik saja. Sementara itu, pada senyawa kovalen tidak. Oleh sebab itulah, timbul konsep redoks yang ketiga, yakni berdasarkan perubahan bilangan oksidasi atau disebut juga biloks. Bilangan oksidasi merupakan muatan positif dan negatif pada suatu atom.
PPT Reaksi Redoks PowerPoint Presentation, free download ID7018645
Sobat Pijar tahu tidak kalau besi yang berkarat saat dibiarkan di luar tanpa penutup adalah salah satu contoh reaksi redoks yang bisa terjadi di sekitar kita, lho! Reaksi redoks adalah salah satu materi dalam pelajaran kimia kelas 12 yang akan kita bahas di bawah ini. Mulai dari pengertiannya, penyetaraan, dan contoh soalnya.

Reaksi Redoks
Proses terjadinya korosi merupakan proses elektrokimia. Elektrokimia adalah proses terjadinya reaksi redoks (reduksi oksidasi) secara spontan. Contohnya, korosi pada besi akan membentuk oksida besi (Fe 2 O 3. x H 2 O). Besi akan teroksidasi oleh oksigen dari udara dan akan membentuk korosi. Persamaan reaksi yang berlangsung adalah sebagai berikut.
Soal Reaksi Redoks Kelas X Semester 2
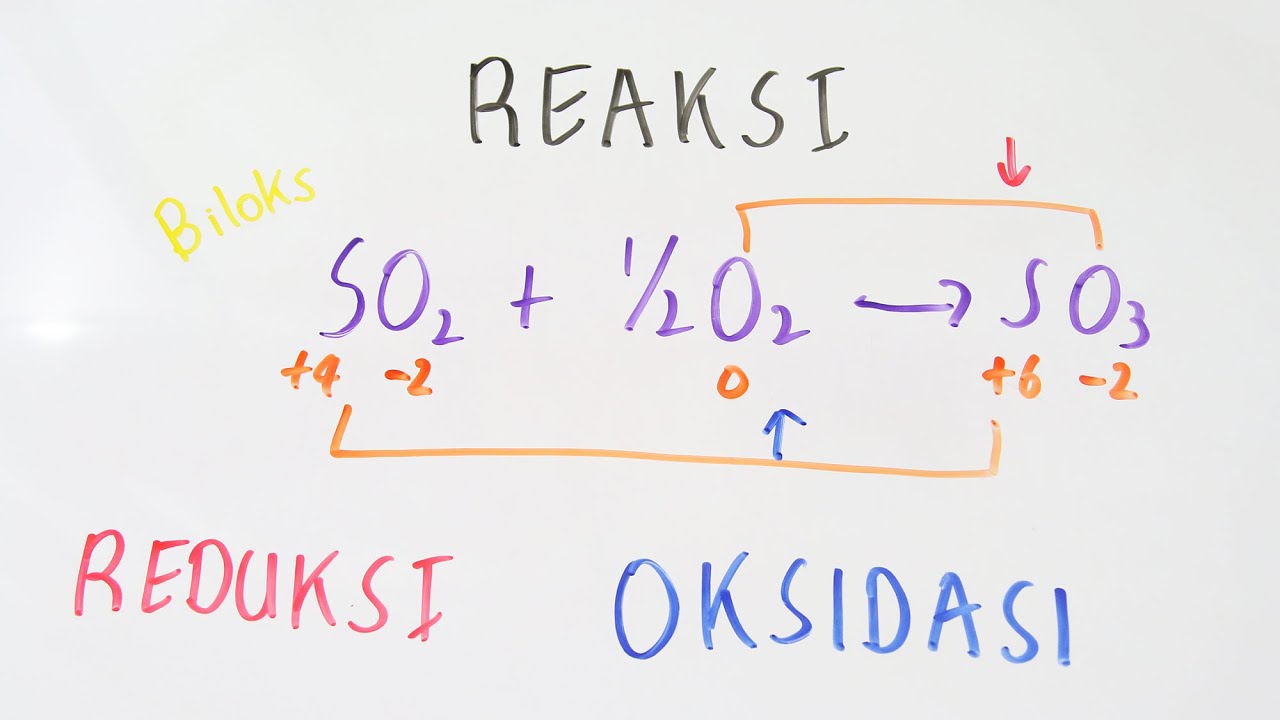
Perkembangan Kosep Reaksi Redoks. Pada mulanya reaksi oksidasi diartikan sebagai reaksi pengikatan oksigen oleh zat tertentu. Sedangkan reaksi reduksi adalah reaksi pelepasan oksigen. Contoh reaksinya yaitu: Oksidasi : H 2 (g) + ½ O 2 (g) → H 2 (l) Reduksi : FeO (s) + CO (g) → Fe (s) CO 2 (g) Namun pendapat tersebut dinilai kurang.

Konsep Reaksi Redoks
Reaksi elektrolisis larutan encer dengan elektrode grafit. Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode. 2. Reaksi elektrolisis larutan dengan elektrode tembaga. Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion di anode dan gas hidrogen di katode. Nah.

REAKSI REDOKS CATATAN KIMIA
Pada reaksi pembakaran gas metana akan menghasilkan gas karbon dioksida dan uap air. 3. Oksidasi glukosa dalam tubuh, glukosa dioksidasi melalui peristiwa respirasi akan dipecah menjadi senyawa yang lebih sederhana seperti karbon dioksida dan air dalam tubuh manusia. 4. Buah apel atau pisang setelah dikupas akan berubah warna menjadi kecoklatan.

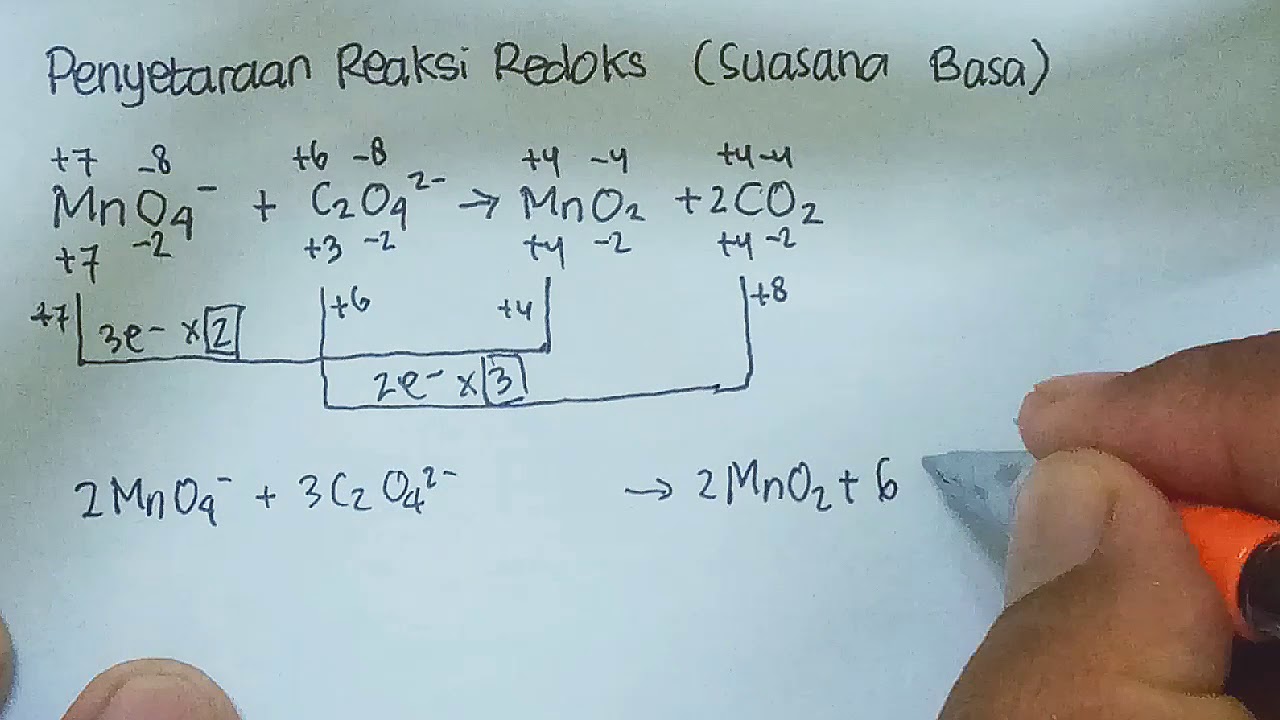
Penyetaraan Reaksi Redoks Cara Setengah Reaksi YouTube
Adapun contohnya adalah di bawah ini. a. Contoh 1: proses berkaratnya logam dan besi akibat unsur besi mengikat oksigen baik dari udara maupun dari air. Reaksinya adalah: 4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s) b. Contoh 2: pembakaran gas metana (CH4) menghasilkan gas karbon dioksida dan uap air.

APAKAH REAKSI REAKSI DI BAWAH INI TERMASUK REAKSI REDOKS ATAU TIDAK? YouTube
Konsep reaksi redoks yang melibatkan perpindahan elektron ini hanya bisa terjadi pada senyawa ionik aja, sedangkan senyawa kovalen tidak. Oleh karena itu, muncul konsep redoks yang ketiga, yaitu berdasarkan perubahan bilangan oksidasi (biloks). Bilangan oksidasi adalah muatan positif dan negatif pada suatu atom.
Contoh Soal Reaksi Redoks Dan Pembahasannya
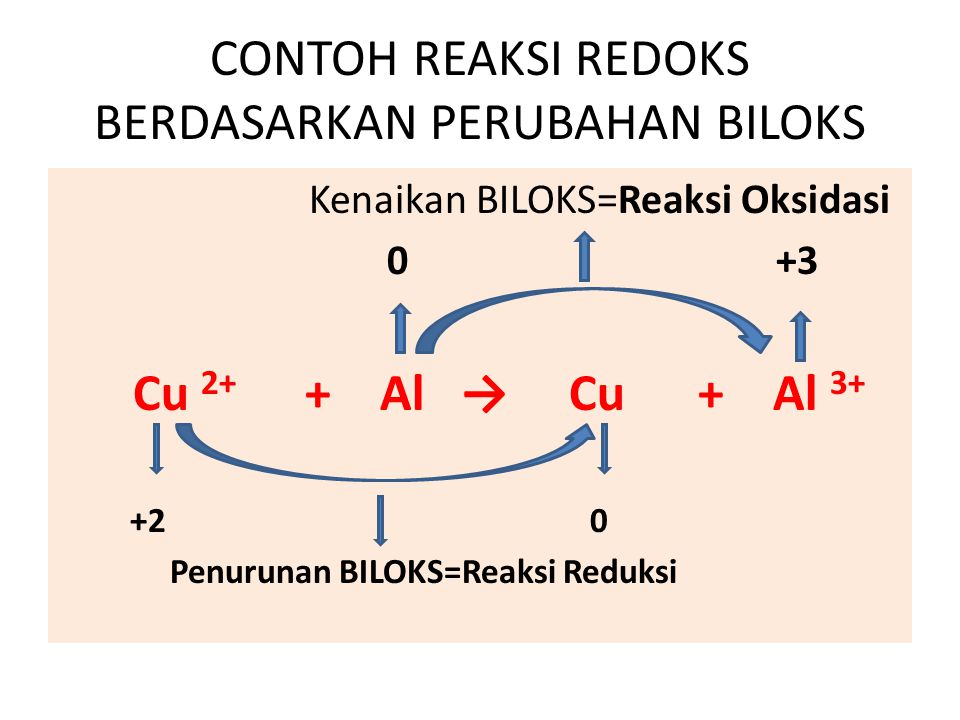
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl ------> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0. Kemudian,

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Apabila suatu zat dapat berperan sebagai oksidator maupun reduktor, maka dapat dikatakan zat tersebut mengalami autooksidasi atau disproporsionasi. Pada keadaan tertentu banyak reaksi redoks yang terjadi namun berlangsung lambat, sehingga apabila ingin mempercepat reaksinya dibutuhkan katalis (Zulaicha & Agustina, 2019).
.png)
Reaksi Redoks Pengertian, Ciri, Konsep, dan Menentukan BIlangan Oksidasi
Reaksi redoks adalah reaksikimia yang menyebabkan adanya perubahan bilangan oksidasi pada suatu unsur, maupun molekul. Selain ditandai dengan perubahan bilangan oksidasi, Reaksi ini juga ditandai dengan penambahan atau pengurangan oksigen dalam suatu molekul. Reaksi redoks terjadi akibat adanya reaksi reduksi dan oksidasi. Reaksi Reduksi
Contoh Reaksi Redoks Dalam Kehidupan Sehari Hari Beserta Reaksinya Berbagai Contoh
D. reaksi pada aki kendaraan E. reaksi bahan bakar dengan oksigen 2. Cl2(g) + 2KBr(aq) 2KCl(aq) + Br2(aq) Reaksi di atas termasuk reaksi.. A. bukan reaksi redoks, sebab tidak meli-batkan oksigen B. bukan reaksi redoks, sebab tidak me-lepas dan menangkap elektron C. reaksi redoks, sebab biloks Cl 2 bertam-bah dari 0 menjadi +l