Video belajar Pengisian Elektron Pada Orbital Kimia untuk Kelas 10 IPA
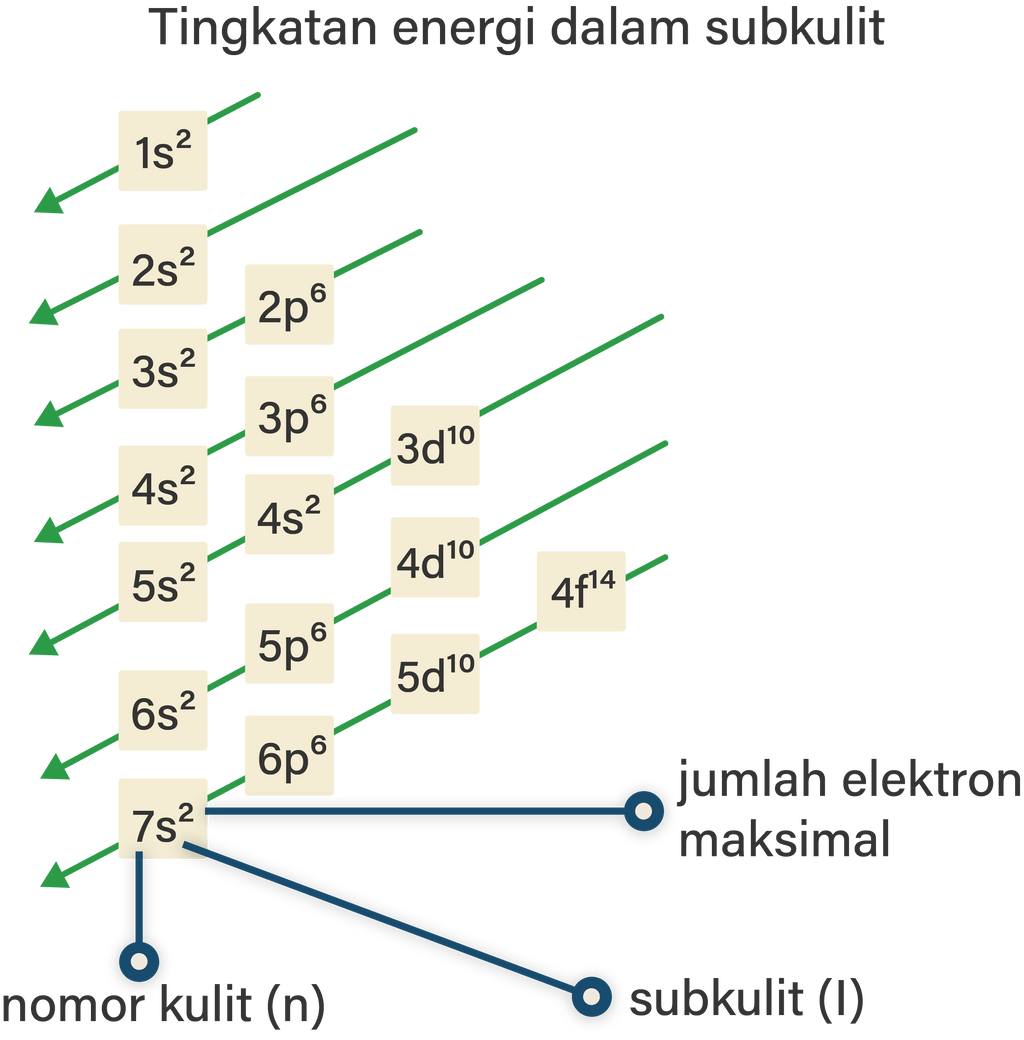
Subkulit 1s punya tingkat energi paling rendah, lalu naik ke subkulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Pastinya elektron yang bisa mengisi subkulit tertentu juga terbatas. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat.

Pengisian Elektron Yang Benar Ditunjukkan Oleh Unsur Berbagai Unsur
Jawaban terverifikasi. Pembahasan. Prinsip aufbau menyatakan bahwa elektron menempati suatu orbital dengan urutan peningkatan energi tertentu. Urutan energi berdasarkan aufbau mengikuti urutan berikut: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p.

Konfigurasi Elektron Dan Nomor Atom Unsur Yang Benar Untuk Unsur Unsur My XXX Hot Girl
Berdasarkan teori ini, elektron harus diisikan dari tingkat energi paling rendah, yaitu kulit K ( n = 1) dan dilanjutkan kulit L ( n = 2), M ( n = 3), N ( n = 4), dan seterusnya. Banyaknya elektron yang mengisi setiap kulit mengikuti rumus 2 n2. Dengan demikian: Kulit K = 2 n2 = 2 (1) 2 = 2 elektron maksimal.

Perhatikan tabel pengisian elektronelektron ke dalam sub...
Struktur Atom dan Tabel Periodik. Konfigurasi Elektron dan Diagram Orbital. Perhatikan tabel pengisian elektron-elektron dalam subkulit berikut! Unsur Pengisian Elektron 7 3 Li 1s^2 2s^1 11 5 B 1s^2 2s^2 3s^1 23 11 Na 1s^2 2s^2 2p^6 3s^1 27 13 AI 1s^2 2s^2 2p^6 3s^2 3p^3 56 26 Fe 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5 Pengisian elektron yang benar.
Jelaskan tentang konfigurasi elektron beserta cont...
Berdasarkan perspektif Bohr, elektron harus diisi dari tingkat energi paling rendah ke tinggi, yaitu secara berurutan mulai dari kulit K (n=1), L (n=2), M (n=3), N (n=4) dan seterusnya. Untuk jumlah elektron maksimal pada lapisan kulit dihitung berdasarkan rumus , dengan penjelasan n = nomor kulit. 2. Konfigurasi Elektron Subkulit.

Pengisian Elektron Yang Benar Ditunjukkan Oleh Unsur Berbagai Unsur
"Pengisian elektron dalam orbital dimulai dari orbital dengan tingkat energi paling rendah. Setelah penuh, pengisian berlanjut ke orbital yang tingakat energinyas atu tingkat lebih tinggi. Demikian seterusnya hingga semua elektron menempati orbital." Aturan Aufbau. Urutan pengisian elektron pada orbital dari tingkat energi yang terendah adalah:

Molekul Unsur Dan Senyawa Secara Berurutan Lengkap
Berdasarkan pengertian diatas dapat dijelaskan bahwa terdapat dua cara dalam suatu penulisan konfigurasi elektron. Cara tersebut yaitu bisa berdasarkan kulit atom atau berdasarkan subkulit atomnya. Konfigurasi elektron ini berdasarkan kulit atom hanya berlaku untuk unsur golongan utama, yaitu unsur golongan IA sampai VIIIA.

Gambarkan Konfigurasi Elektron Untuk Atom Netral
Pembahasan. Pengisian elektron harus berlandaskan prinsip aufbau dan aturan hund yaitu: Prinsip Aufbau, pengisian elektron dimulai dari sub kulit yang memiliki tingkat energi rendah menuju tingkat energi yang tinggi.

Pengertian Konfigurasi Elektron Ilmu Kimia
Pada modul ini akan dipelajari bagaimana memperkiran bentuk molekul suatu senyawa dengan menggunakan teori Valence Shell Electron Pair of Repulsion (VSEPR) dan Teori Domain Elektron dan mengaitkan dengan sifat fisik suatu senyawa terutama titik didih/titik leleh. Download Free PDF. View PDF.

Pengisian elektron pada orbital yang benar adalah.
Prinsip Aufbau. Prinsip ini menyatakan bahwa pengisian elektron dimulai dari tingkat energi terendah menuju tingkat energi yang lebih tinggi. Bila digambarkan maka sebagai berikut: Beberapa kaidah yang harus diikuti dalam penentuannya adalah. Urutan pengisian orbital mengacu pada arah urutan panah, yaitu 1s, 2s, 2p, 3s, 3p dan sterusnya. b.

Konfigurasi Elektron Dalam Orbital Untuk Unsur 18Ar Adalah Ujian
Sehingga, pengisian elektron - elektron yang sesuai dengan aturan Aufbau dan Hund adalah unsur W dan Z. Jadi, jawaban yang benar adalah C. Menurut Aufbau, pengisian elektron ke dalam orbital selalu dimulai dari orbital dengan tingkat energi rendah ke tingkat energi yang lebih tinggi.

Diagram lintasan elektron unsur P dengan nomor atom = 15
Elektron - Wikipedia Bahasa Melayu, ensiklopedia bebas. Elektron adalah satu zarah subatom keunsuran berjisim ringan yang membawa cas negatif cas elektrik. Elektron mempunyai spin 1/2 ( fermion ), tidak terlibat di dalam salingtindak kuat ( lepton) dan tidak mempunyai substruktur.

Perhatikan tabel pengisian elektronelektron berikut! Uns...
Unsur memiliki peran penting dalam pengisian elektron yang benar. Dalam prosesnya, elektron akan diisi secara berurutan sesuai dengan konfigurasi elektronik masing-masing unsur. Dengan memahami bagaimana pengisian elektron dilakukan oleh sebuah unsur, kita dapat memperoleh pengetahuan yang berguna untuk menghasilkan senyawa dan reaksi kimia.

Pengisian Elektron Yang Benar Ditunjukkan Oleh Unsur Berbagai Unsur
Aturan Aufbau. "Pengisian elektron dalam orbital dimulai dari orbital dengan tingkat energi paling rendah. Setelah penuh, pengisian berlanjut ke orbital yang tingkat energinya satu tingkat lebih tinggi. Demikian seterusnya hingga semua elektron menempati orbital". Skema energi pada aturan Aufbau digambarkan sebagai berikut: Aturan Hund.

Perhatikan konfigurasi elektron unsur dan Y berikut! Jika...
Yang membedakannya hanya bilangan kuantum spin (s)." Sumber: kompas.com. Hal ini berarti bahwa setiap orbital maksimum berisi dua elektron dengan arah spin yang berlawanan. Misalnya suatu atom memiliki 2 elektron yang menghuni orbital 1s, maka diagram orbital yang benar menurut Larangan Pauli ditunjukkan oleh gambar c. Aturan Hund

Konfigurasi Elektron Ion Panduan Lengkap dan Terperinci
Urutan energi berdasarkan aufbau mengikuti urutan berikut: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p. Subkulit s: maksimal diisi 2 elektron. Subkulit p: maksimal diisi 6 elektron. Subkulit s: maksimal diisi 10 elektron. Subkulit s: maksimal diisi 14 elektron.