
Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Molalitas adalah besaran yang menunjukkan jumlah mol zat terlarut pada setiap satuan berat pelarut. Molalitas dinyatakan dalam satuan molal (m) atau mol/kg. Rumus molalitas untuk (n) mol senyawa yang dilarutkan ke (P) kilogram pelarut adalah sebagai berikut :

Perbedaan Rumus Molaritas Dan Molalitas 52 Riset
Molalitas - Pengertian, Rumus, dan Contoh Soal. Molalitas suatu larutan bisa diuji dengan menambahkan beberapa zat pelarut. Pada waktu membuat sirup, kamu tentu melarutkan sirup ke dalam air, semakin banyak sirup yang dilarutkan semakin manis minuman yang terjadi. Sirup disebut zat terlarut (solute) dan air disebut zat pelarut (solvent).

Molalitas Pengertian, Satuan, Rumus, dan Contoh Soal Menghitungnya
Rumus normalitas kimia adalah N = n x a /V, yang menyatakan nilai normal (N) yang sama dengan satu mol ekivalen/liter. Dalam kimia, terdapat beberapa besaran yang dapat digunakan untuk menyatakan suatu konsentrasi zat terlarut dalam sebuah larutan antara lain yaitu molaritas, molalitas, normalitas dan fraksi mol.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Rumus Molalitas. Lalu, rumus molalitas itu apa ya, guys? Ini dia rumusnya: m = n/p. Keterangan: m : molalitas suatu zat (molal) n: mol suatu zat (mol) p: massa pelarut (g) Biar lebih paham cara mencari molalitas menggunakan rumus di atas, di bawah ini gue kasih latihan soal buat elo berlatih.
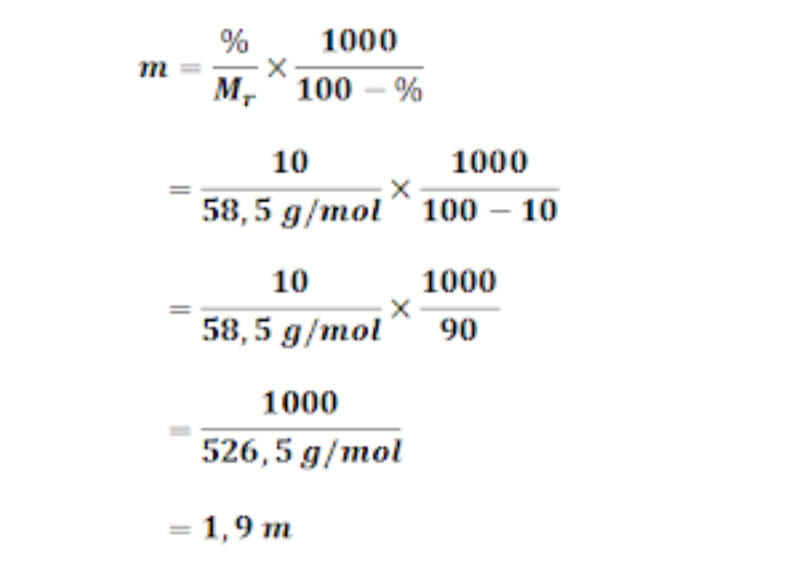
Cara Menghitung dan Contoh Soal Fraksi Mol dan Jawabannya Rumus dan Pembahasan Fraksi Mol
Rumus normalitas digunakan untuk menghitung konsentrasi larutan dalam ilmu kimia. Contohnya, dengan menggambarkan jumlah mol ekivalen dalam per liter larutan. Sedangkan, molaritas merupakan satuan yang menyatakan jumlah zat terlarut per liter larutan dan molalitas dalam 1.000 gram pelarut. Mengutip Jurnal Biomedika Volume 10 Nomor 1 berjudul.

Konsep Molalitas Beserta Contoh Soal YouTube
Rumus Molalitas. Molalitas larutan dinyatakan dengan persamaan dibawah ini: molal = n/p. Dengan. n = jumlah mol zat pelarut (mol) p = massa pelarut (kg) molal = molalitas (mol/kg) Jika massa pelarut dalam satuan gram, maka rumus yang digunakan sebagai berikut: molal = n x (1000/p)

Cara Menghitung Molaritas, Molalitas, dan Fraksi Mol YouTube
Molalitas yaitu besaran yang menyatakan jumlah mol zat terlarut pada tiap satuan berat pelarut. Satuan molalitas ialah molal (m) yang sama dengan mol/kilogram. Jika n mol senyawa dilarutkan dalam P kilogram pelarut, maka rumus molalitas larutan yaitu : m = n/p. Keterangan: m = molalitas suatu zat (molal) p = massa pelarut (gr) n = mol suatu zat.

Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Molalitas ( b ), dari suatu larutan didefinisikan sebagai jumlah zat (dalam mol) terlarut, nterlarut, dibagi dengan massa (dalam kg) pelarut, mpelarut: [1] Dalam kasus larutan dengan lebih dari satu pelarut, molalitas dapat didefinisikan bagi pelarut campuran yang dianggap sebagai suatu pseudo-pelarut murni. Alih-alih mol terlarut per kilogram.

Contoh soal MOLARITAS YouTube
Satuan molalitas. Molalitas adalah besaran turunan yang memiliki satuan. Dilansir dari ChemistryGod, satuan standar molalitas adalah mol per kilogram (mol/kg) atau kerap disebut sebagai molal. Molal biasanya dilambangkan dengan huruf "m". Misalnya, molalitas suatu larutan adalah 12 mol/kg, maka dapat dinyatakan sebagai 12 molal atau 12 m.

Perbedaan Molaritas Dan Molalitas Riset
Berikut adalah rumus-rumus molaritas! M = g/Mr x 1.000/V atau M = n/V. Dengan, M: molaritas (mol/L) n: jumlah mol zat g: massa zat terlarut (gram) Mr: massa molekul relatif zat terlarut (g/mol) V: volume larutan (mL) Baca juga: Soal UAS Kimia: Prinsip Molalitas dan Molaritas. Selain rumus molaritas, ada juga yang disebut sebagai persamaan.

Rumus Molaritas dan Molalitas 65
Rumus Molaritas. Molaritas termasuk konsentrasi larutan. Dari berbagai bentuk konsentrasi yang dipengaruhi sifat koligatif larutan yaitu molaritas, molalitas, dan fraksi mol. Satuan molaritas adalah mol/liter atau M. Rumus molaritas yaitu mol zat terlarut dibagi volume larutan. Tetapi, molaritas dapat dicari melalui massa jenis zat terlarut dan volume larutan.

Rumus Molaritas, Definisi, Persamaan Molaritas, Contoh Soal
Baca juga: Rumus Luas Permukaan Prisma Segitiga, Lengkap dengan Cara Menghitungnya. Rumus Molaritas. Molaritas ini merupakan jenis konsentrasi larutan yang dipengaruhi oleh sifat koligatif larutan, yaitu molaritas, molalitas, dan fraksi mol. Rumus molaritas sendiri adalah mol zat terlarut yang dibagi dengan volume larutan, sementara satuannya.
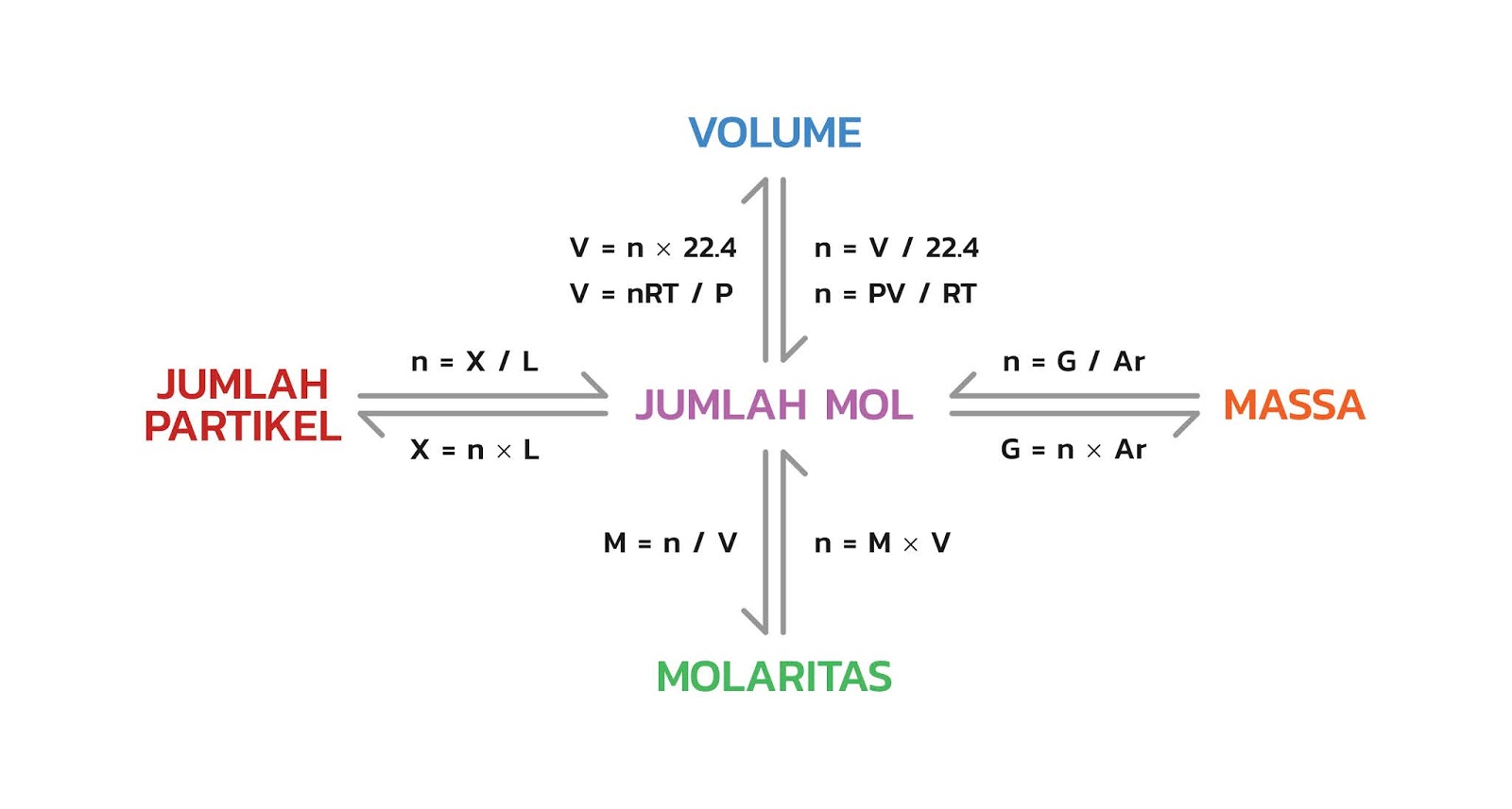
Hubungan Mol Dengan Jumlah Partikel Massa Volume Dan Molaritas Riset
Rumus Molalitas Molalitas merupakan besaran turunan yang memiliki satuan. Adapun, satuan standar molalitas adalah mol per kilogram (mol/kg) atau sering kali disebut sebagai molal. Lambang dari molal adalah huruf "m". Sebagai contoh suatu larutan adalah 13 mol/kg maka dapat dinyatakan sebagai 12 molal atau 12 m..

Rumus Normalitas, Molaritas, Molalitas Pengertian, Rumus, Contoh Soal dan Pembahasan
Rumus Normalitas, Molaritas, dan Molalitas - Rumus normalitas, molaritas, dan molalitas merupakan pelengkap dari pembahasan mengenai unit maupun satuan untuk menyatakan konsentrasi larutan. Materi ini secara umum dijelaskan melalui mata pelajaran IPA atau Ilmu Pengetahuan Alam pada jenjang pendidikan SMA atau sederajat.

Hubungan molaritas, massa jenis larutan dan kadar zat YouTube
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30 g.

CARA MUDAH MERUBAH PERSEN MENJADI MOLARITAS PADA SOAL PENGENCERAN 001 YouTube
Untuk itu, digunakan molalitas yang menyatakan jumlah partikel zat terlarut (mol) setiap 1 kg pelarut (bukan larutan). Larutan yang dibuat dari 1 mol NaCl yang dilarutkan dalam 1.000 g air dinyatakan sebagai larutan 1 molal dan diberi lambang 1 m NaCl. Molalitas didefinisikan dengan persamaan berikut. Rumus atau Persamaan Perhitungan Molalitas