Ion dan Ikatan Ion YouTube
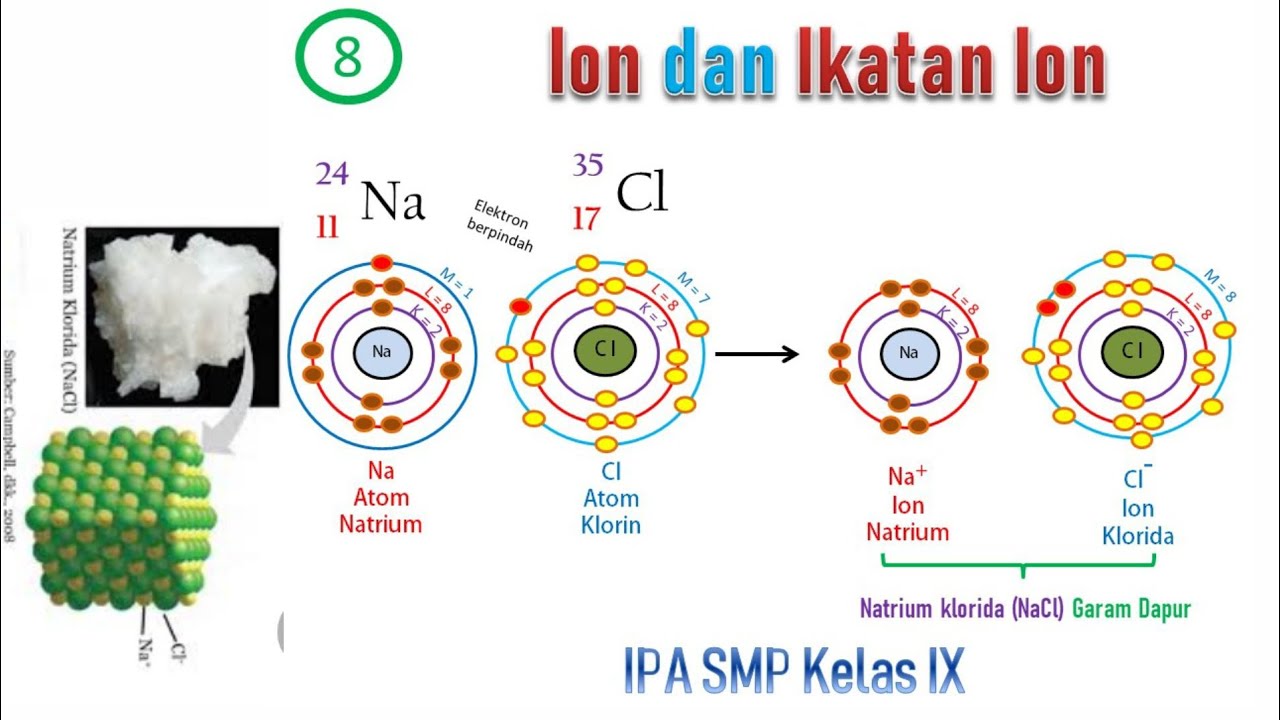
Ikatan kimia merupakan gaya yang mengikat dua atom atau lebih untuk membuat senyawa atau molekul kimia. Ikatan itulah yang akan menjaga atom tetap bersama dalam suatu senyawa yang dihasilkan. Dengan kata lain, ikatan kimia dari dua atau lebih unsur disebut senyawa. Kayak di contoh tadi ada senyawa dari garam dapur.
Pengertian Ikatan Kimia Macam Jenis dan Contoh Ikatan JAGAD ID
Proses pembentukan KCl juga melibatkan pelepasan elektron oleh K dan penangkapan elektron oleh Cl, membentuk ion K+ dan Cl-. Reaksi ikatan ion K+ + Cl- menghasilkan senyawa KCl. Contoh lain ialah senyawa Al2O3 (aluminium oksida). Ikatan ion terjadi antara unsur logam Al dari golongan IIIA dan unsur nonlogam O dari golongan VIA.

LENGKAP ‼️ PEMBENTUKAN SENYAWA ION DARI KATION DAN ANION ‼️ KIMIA KELAS 10 YouTube
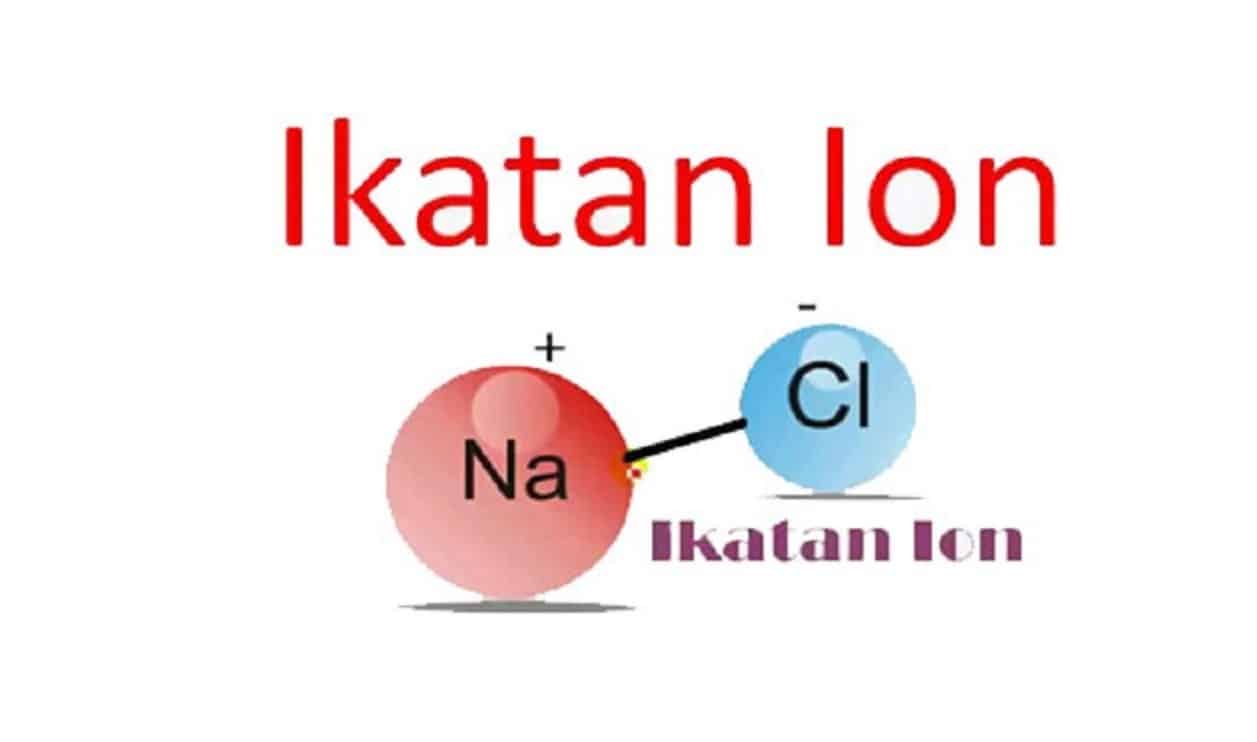
Dalam NaCl padat terdapat ikatan antara ion Na+ dan ion Cl- dengan gaya elektrostatik, sehingga disebut ikatan ion. Pada ikatan ionik, terjadi transfer elektron dari satu atom ke atom lainnya. Oleh karena berpindahnya elektron, maka atom yang mendapatkan elektron menjadi bermuatan negatif, sedangkan atom yang kehilangan elektron akan bermuatan.

Ikatan Ion Beserta Contoh Ikatannya Rumus Kimia
Ikatan Ion. Ikatan kimia yaitu ikatan yang bisa terjadi karena adanya berbagai unsur didalam kondisi yang tidak stabil. Tapi, berusaha menjadi stabil seperti gas mulia dengan cara membentuk ikatan dengan unsur yang lain. Kalo dilihat dari jenisnya ikatan kimia dibagi menjadi 2, yaitu ikatan kovalen dan ikatan ion.
Apa Itu Ikatan Ion? Proses Pembentukan dan Contohnya
Ikatan Na dan Cl ini menghasilkan senyawa ionik berupa natrium klorida, yaitu garam dapur yang biasa kita gunakan. Ikatan kovalen. Ikatan kovalen adalah ikatan kimia yang terbentuk antara senyawa logam dan non-logam. Ikatan kovalen tersebut terjadi karena penggunaan pasangan elektron secara bersamaan oleh unsur-unsur non-logam.
Contoh Soal Ikatan Ion Dan Kovalen
Ikatan ion antara Li dan F. 10. Ikatan ion antara K dan Cl. 2.9k. Ikatan ion adalah ikatan yang terbentuk karena adanya serah terima elektron antara unsur logam dengan unsur nonlogam. Contoh ikatan ion yaitu terdapat pada senyawa NaCl, MgCl 2, BaCl 2, CaF, dan LiF. Untuk lebih memahami bagaimana proses pembentukan ikatan ion.

Ikatan Ion Beserta Contoh Ikatannya Rumus Kimia
Sifat Fisis Ikatan Ion. Sifat pada senyawa ion ini berdasarkan gaya elektrostatis yang kuat antara ion positif dan negatif. Beberapa sifat fisis ikatan ion yaitu: 1. Bersifat keras tetapi rapuh. 2. Memiliki titik leleh dan titik didih yang tinggi. 3. Larut dalam pelarut air dan tidak larut dalam pelarut organik.

3 contoh senyawa ion kovalen dan logam Alexandra Springer
Berikut ini akan dijelaskan proses pembentukan ikatan ion antara atom unsur golongan IA dan IIA dengan atom unsur golongan VIA dan VIIA. 1. Ikatan ion antara unsur golongan IA dengan VIIA. Contoh Ikatan antara atom 12 Mg dan 17 Cl dalam MgCl 2. Konfigurasi elektron Mg dan Cl adalah: Mg: 2, 8, 2 (melepas 2 elektron) membentuk.

Senyawa Ion dan Contoh Pembentukan Senyawa Ion Belajar IPA
Simak beberapa ikatan yang terjadi antara unsur-unsur berikut: Baca Juga: Meramalkan Bentuk Molekul dengan Teori Domain Elektron (VSEPR) 1. Kalium 19K dengan Oksigen 8O. Konfigurasi: 19 K : 2 8 8 1 -> K + : 2 8 8 + 1e | melepas 1 elektron. 8 O : 2 6 + 2e -> O 2- : 2 8 | menerima 2 elektron. K cenderung melepas 1 elektron membentuk ion K.
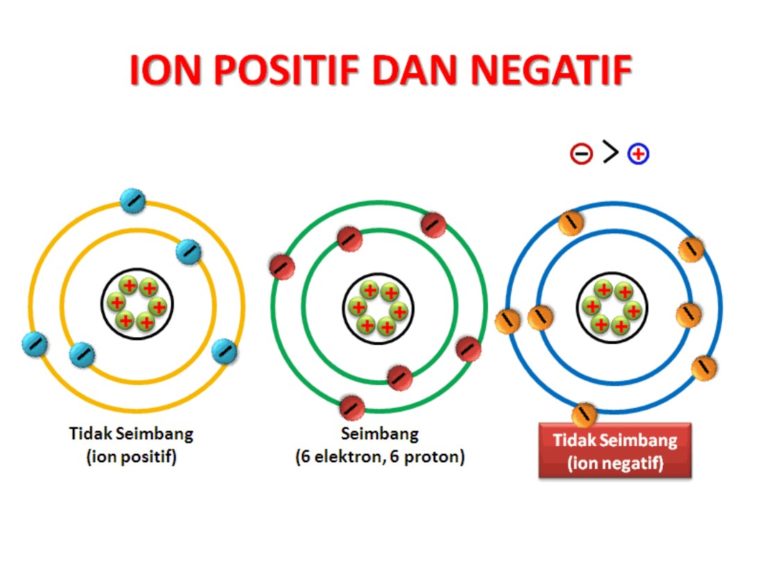
Pengertian Ion dan Contohnya Konsep dan Jenisjenis Ion dalam Kimia
O + 2e - → O 2-. Cr 3+ + O 2- → Cr 2 O 3. Contoh soal 3. Jelaskan terjadinya ikatan ion dan tulislah ikatan ion yang terjadi pada: Ca (golongan IIA) dan N (golongan VA) Na (golongan IA) dan S (golongan VIA) Pembahasan. Jawaban soal 1 sebagai berikut: elektron valensi Ca = 2 karena golongan IIA sehingga melepas 2e.

Ikatan Ion atau Elektrovalen Kimia Kelas 10 YouTube
Pembentukan Natrium klorida (khanacademy.org) Na kelebihan 1 elektron untuk menjadi 8, sedangkan Cl kekurangan 1 elektron untuk menjadi 8. Sehingga Na melepaskan 1 elektronnya dan berubah menjadi kation. Lalu 1 elektron tersebut ditangkap oleh Cl, sehingga Cl berubah menjadi anion. Terbentuklah ikatan ionic molekul NaCl antara ion Na+ dan Cl-.

Contoh Soal Ikatan Ion Dan Kovalen
Modul, Rumus, & Soal Ikatan Ionik. Kalau kamu ingin belajar materi ikatan ionik secara lebih mendalam, coba simak penjelasan yang ada di sini. Setelah menerima materi, kamu bisa langsung mempraktikkannya dengan mengerjakan latihan soal yang telah kami sediakan. Lewat pembahasan ini, kamu bisa belajar mengenai Ikatan Ionik, kamu akan diajak.
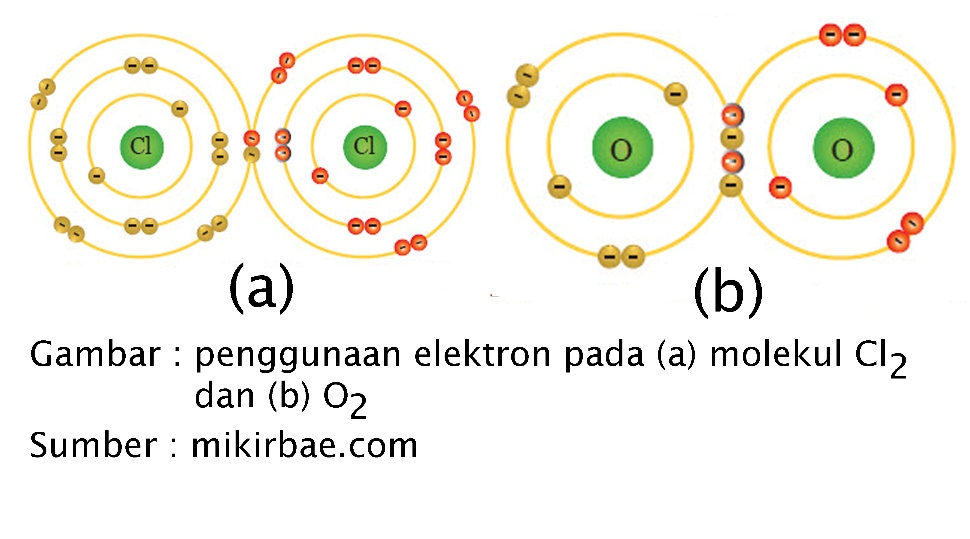
Prinsip Pembentukan Molekul dan Ion POJOK IPA
Konfigurasi elektron Cl : 2 8 7, elektron valensi = 7. Agar kedua atom tersebut stabil, maka atom Ca cenderung melepas 2 elektron membentuk Ca 2+ dan atom Cl cenderung menerima 1 elektron membentuk Cl -.. Ca (2 8 8 2) → Ca 2+ + 2e -. Cl (2 8 7) + 1e - → Cl - (2x). Reaksi : Ca + 2Cl → Ca 2+ + 2Cl - → CaCl 2. Baca juga Tata Nama Senyawa.. Ikatan Kovalen

Ikatan Ion (Ikatan Elektrovalen) Ikatan Kimia Kelas 10 YouTube
Reaksi ikatan ion: Mg 2+ + 2 Br - → MgBr 2. Jadi, banyaknya unsur Mg yang dibutuhkan untuk membentuk ikatan ion adalah 1. Jawaban: A. Contoh Soal 3. Rumus ikatan ion yang terjadi antara unsur Ca dan Cl adalah.. (nomor atom Ca = 20, nomor atom Cl = 17) Ca 2 Cl 2; Ca 2 Cl 3; CaCl 3; Ca 2 Cl; CaCl 2; Pembahasan: Mula-mula, kamu harus.

Semanis SUKROSA Struktur Molekul Sesuai Aturan Lewis
Dalam NaCl padat terdapat ikatan antara ion Na + dan ion Cl - dengan gaya elektrostatik, sehingga disebut ikatan ion. Bentuk kristal NaCl merupakan rangkaian antara ion Na + dan ion Cl -. Satu ion Na + dikelilingi oleh enam ion Cl - dan satu ion Cl - dikelilingi oleh enam ion Na + seperti yang diilustrasikan oleh gambar di bawah.

Ikatan Ion Beserta Contoh Ikatannya Rumus Kimia
Pengaruh muatan ion. Ketika kita memperhatikan ikatan ion yang terjadi antara litium fluorida dengan magnesium oksida, kita menemukan kation dengan jari-jari yang hampir sama (Li + = 76 pm dan Mg 2+ = 72 pm) dan anion dengan jari-jari yang hampir sama (F - =133 pm dan O 2-= 140 pm).. Dengan demikian, satu-satunya perbedaan yang signifikan adalah muatan ion.