
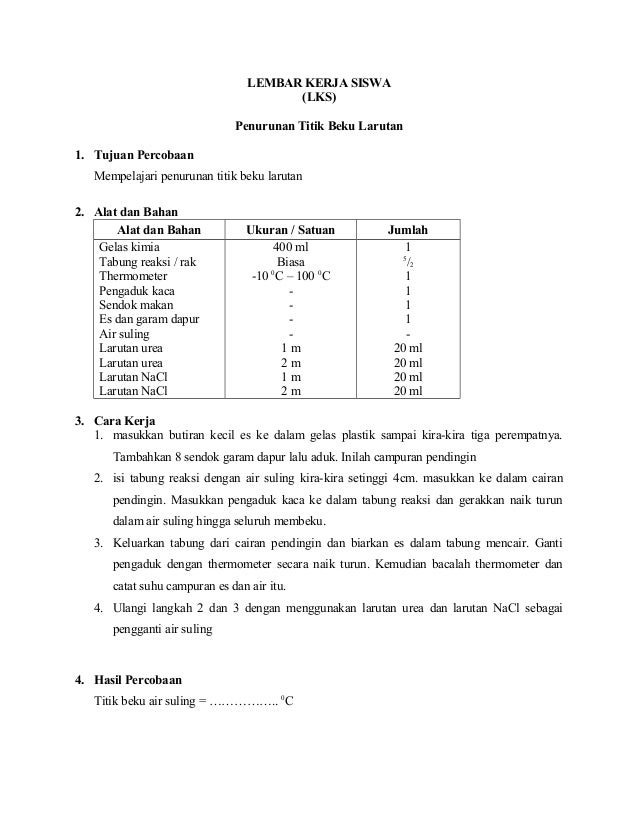
Kumpulan Contoh Soal Penurunan Titik Beku Kimia Kelas 12 CoLearn halaman 2
Mengenal Rumus dan Contoh Soal Hukum Hess. ∆Tf = Tf (pelarut) - Tf (larutan) ∆Tf = m . Kf. Keterangan: ∆Tf = penurunan titik beku (freezing point depression) m = molalitas. Kf = tetapan penurunan titik beku (ºC kg/mol) Untuk mengaplikasikan rumus di atas, Anda bisa menyimak contoh soal di bawah ini agar meningkatkan pemahaman.

Contoh Soal Penurunan Titik Beku Dan Pembahasan Reverasite Reverasite
Dikutip dari buku Belajar Kimia Secara Menarik untuk SMA/MA Kelas XII yang ditulis oleh Das Salirawati, dkk (2007: 16), berikut adalah 4 contoh soal penurunan titik beku dan pembahasannya: 1. Tentukan titik beku larutan 0,025 mol suatu senyawa dalam 250 gram air, jika Kf air = 1,86º C/m! Jawaban: m = n/p = 0,025 mol/0,25 kg = 0,1 m. Delta Tf = m .

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
1. Titik Beku (Tf) Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku ( Tf) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar 0ºC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0ºC.

Materi Penurunan Titik Beku Beserta Contoh Soal Dan Pembahasan Reverasite
Sonora.ID- Berikut ini adalah ulasan tentang 10 Contoh Soal Titik Didih dan Titik Beku Lengkap Beserta Jawabannya. Titik didih dan titik beku adalah dua sifat fisik penting dari suatu zat yang berkaitan dengan fase zat tersebut, baik itu padat, cair, atau gas. Titik didih adalah suhu di mana zat berubah dari fase cair menjadi fase gas.
Contoh soal kimia penurunan titik beku 2021
Nah, disini saya akan membahas mengenai penuruan titik beku dalam kehidupan sehari-hari. Yuk simak artikel ini sampai selesai! Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Penurunan titik beku dalam kehidupan sehari-hari yaitu : 1. Antibeku Dalam Tubuh Hewan

Materi Penurunan Titik Beku Beserta Contoh Soal Dan Pembahasan Reverasite
Secara umum, penurunan titik beku dapat dijelaskan oleh Hukum Raoult dan hukum konsentrasi molal. Hukum Raoult menyatakan bahwa tekanan uap suatu pelarut ideal adalah produk dari fraksi mol pelarut dan tekanan uap pelarut murni. Dengan adanya zat terlarut (non-volatil), tekanan uap pelarut menurun, dan sebagai hasilnya, titik beku pelarut.
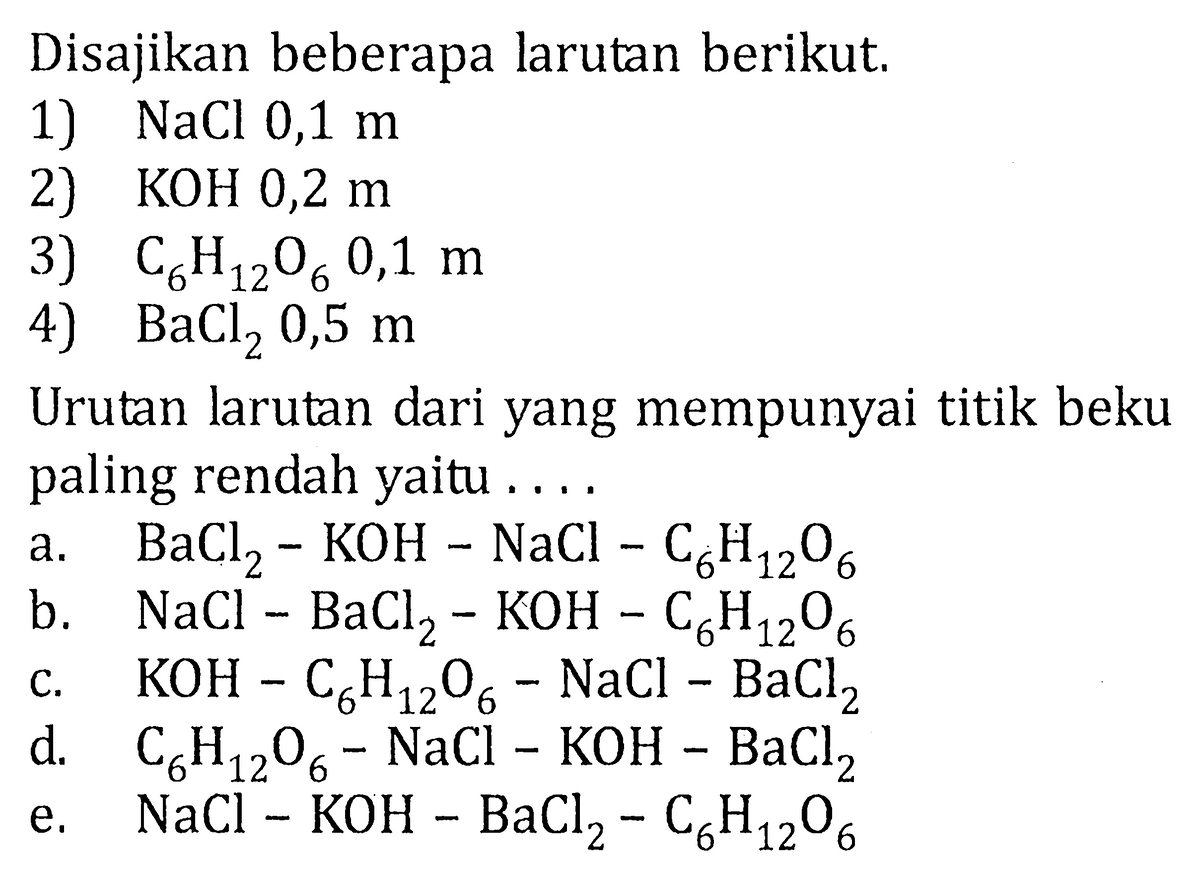
Kumpulan Contoh Soal Penurunan Titik Beku Kimia Kelas 12 CoLearn halaman 27
berikut KUMPULAN SOAL DAN PEMBAHASAN PENURUNAN TITIK BEKU (∆Tf) part 1. SOAL : Sebanyak 8 gram zat A dilarutkan kedalam 200 ml air. Jika diketahui tetapan penurunan titik beku air (Kf) air 1,86 /molal dan massa molar zat tersebut adalah 40 gr/mol , hitung titik beku larutan ! Dalam 200 gram air terlarut 10 gram urea CO (NH 2) 2.

penurunan titik beku (soal 5) sifat koligatif kimia kelas 12 YouTube
Ilustrasi gambar (pexels.com) Hukum Roult merupakan dasar dari sifat koligatif larutan. Keempat sifat itu ialah: 1.Penurunan tekanan uap. 2.Peningkatan titik didih. 3.Penurunan titik beku. 4.Gejala tekanan osmotik. Jadi gitu guys pembahasan mengenai Sifat Koligatif Larutan.

Contoh Soal Kimia Sifat Koligatif Larutan Penurunan Titik Beku YouTube
Ada soal dan pembahasan tentang penurunan titik beku nih.Di sini yang ditanya dibalik sih. Titik bekunya diketahui lalu ditanyakan massa zat terlarut yang di.

Kumpulan Contoh Soal Penurunan Titik Beku Kimia Kelas 12 CoLearn halaman 31
Video Contoh Soal Penurunan Titik Beku Kelas 12. 01:10. Penurunan titik beku molal ialah penurunan titik beku yan. Penurunan Titik Beku; Sifat Koligatif Larutan;. Cari soal Matematika, Fisika, Kimia dan tonton video pembahasan biar ngerti materinya. Matematika, Fisika dan Kimia;

Penurunan Titik Beku Larutan Elektrolit Reverasite
Contoh Soal Penurunan Titik Beku Larutan Elektrolit. Berikut ini adalah contoh soal penurunan titik beku larutan elektrolit: Sebuah larutan CaCl2 memiliki konsentrasi molal sebesar 0,5 mol/kg. Faktor vant Hoff (i) untuk CaCl2 adalah 3. Hitunglah penurunan titik beku larutan tersebut jika konstanta kriometri Kf = 1,86 °C/m.

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

Kumpulan Contoh Soal Penurunan Titik Beku Kimia Kelas 12 CoLearn halaman 17
Jawaban: Contoh penerapan sifat koligatif yang berkaitan dengan penurunan titik beku meliputi: Penggunaan garam dapur untuk mencairkan salju. Penambahan etilena glikol pada radiator mobil. Pembuatan es krim menggunakan campuran garam dapur. 3. Sebanyak 18 gr glukosa (Mr = 180) dilarutkan dalam 500 gram air.

Contoh Soal Kimia Penurunan Titik Beku Soal Kelasmu
Contoh Soal Penurunan Titik Beku - Membahas mengenai perhitungan suatu proses kimia terkait zat berbentuk larutan. Dimana reaksi penurunan titik beku tersebut terjadi pada saat suatu larutan saat ditambahkan senyawa lain. Jika dilihat dari sudut pandang ilmu kimia, larutan mempunyai berbagai sifat baik dalam bentuk sifat kimia ataupun sifat fisis.. Dimana salah satu materi sifat fisis.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Contoh soal sifat koligatif larutan kenaikan titik didih dan penurunan titik beku adalah sebagai berikut: Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih. Soal No. 1. Natrium hidroksida 1,6 gram dilarutkan dalam 500 gram air. Hitung titik didih larutan tersebut! (K b air = 0,52 0 C/m, Ar Na = 23, Ar O = 16, Ar H = 1) Pembahasan: Diketahui:

Contoh Soal Kimia Tentang Penurunan Titik Beku Guru Luring
Kenali Fenomena Sederhana Ini dengan Menjelajahi Soal Penurunan Titik Beku Air, Cokelat, Es Krim dan Banyak Lagi!. Penurunan titik beku adalah salah satu contoh sifat kolligatif larutan, yaitu sifat yang tergantung pada jumlah partikel pelarut, bukan identitasnya. Dalam hal ini, penurunan titik beku tidak bergantung pada jenis zat terlarut.