
Materi Penurunan Titik Beku Beserta Contoh Soal Dan Pembahasan Reverasite
Video Contoh Soal Penurunan Titik Beku Kelas 12. 01:10. Penurunan titik beku molal ialah penurunan titik beku yan. Penurunan Titik Beku; Sifat Koligatif Larutan;. Jika harga Kf air = 1,86 C/molal maka titik beku larutan. Penurunan Titik Beku; Sifat Koligatif Larutan; Kimia Fisik dan Analisis; Kimia; Share. 01:48. Pernahkah Anda melihat.

Contoh Soal Penurunan Titik Beku Larutan Literasi Sekolah
Pada larutan non elektrolit faktor Van't Hoffnya adalah 1 sehigga faktor Van't Hoff ( i ) tidak wajib ditulis dalam perhitungan untuk larutan non elekrolit. Secara teori, faktor Van't Hoff dapat dihitung dengan menggunakan rumus: Dimana n adalah jumlah ion yang terbentuk dalam larutan dikalikan derajat ionisasi zat terlarut.

Contoh Soal Kimia Sifat Koligatif Larutan Penurunan Titik Beku YouTube
Contoh Soal Penurunan Titik Beku Larutan Elektrolit. Berikut ini adalah contoh soal penurunan titik beku larutan elektrolit: Sebuah larutan CaCl2 memiliki konsentrasi molal sebesar 0,5 mol/kg. Faktor vant Hoff (i) untuk CaCl2 adalah 3. Hitunglah penurunan titik beku larutan tersebut jika konstanta kriometri Kf = 1,86 °C/m.

Contoh Soal Titik Beku Senyawa Kompleks (Sifat Koligatif Larutan Elektrolit) YouTube
Oleh Yusup JunaediTf = Tf° - ∆Tf∆Tf = kf x mm = gr/Mr x 1000/grPJika ada pertanyaan silahkan email ke [email protected]

Penurunan Titik Beku Larutan Definisi Dan Penyebabnya Reverasite
Menurut hukum Backman dan Raoult menyatakan bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya. Berikut rumusnya. ΔTf = m x Kf. Keterangan : Tf larutan (Tb) = Titik beku larutan (°C) Tf pelarut (Tb°) = Titik beku pelarut (°C) ΔTf = Penurunan titik beku (°C) m = Molalitas.
Modul I Sifat Koligatif Larutan Penurunan Titik Beku Larutan Mobile
2. Penurunan Titik Beku Larutan Apabila ke dalam sebuah zat pelarut ditambahkan zat terlarut, maka akan terjadi proses penurunan tekanan uap jenuh larutan. Kemudian, adanya penurunan tekanan uap jenuh larutan akan mengakibatkan penurunan titik beku larutan. Dapat dikatakan bahwa, larutan akan membeku pada temperatur yang lebih rendah.

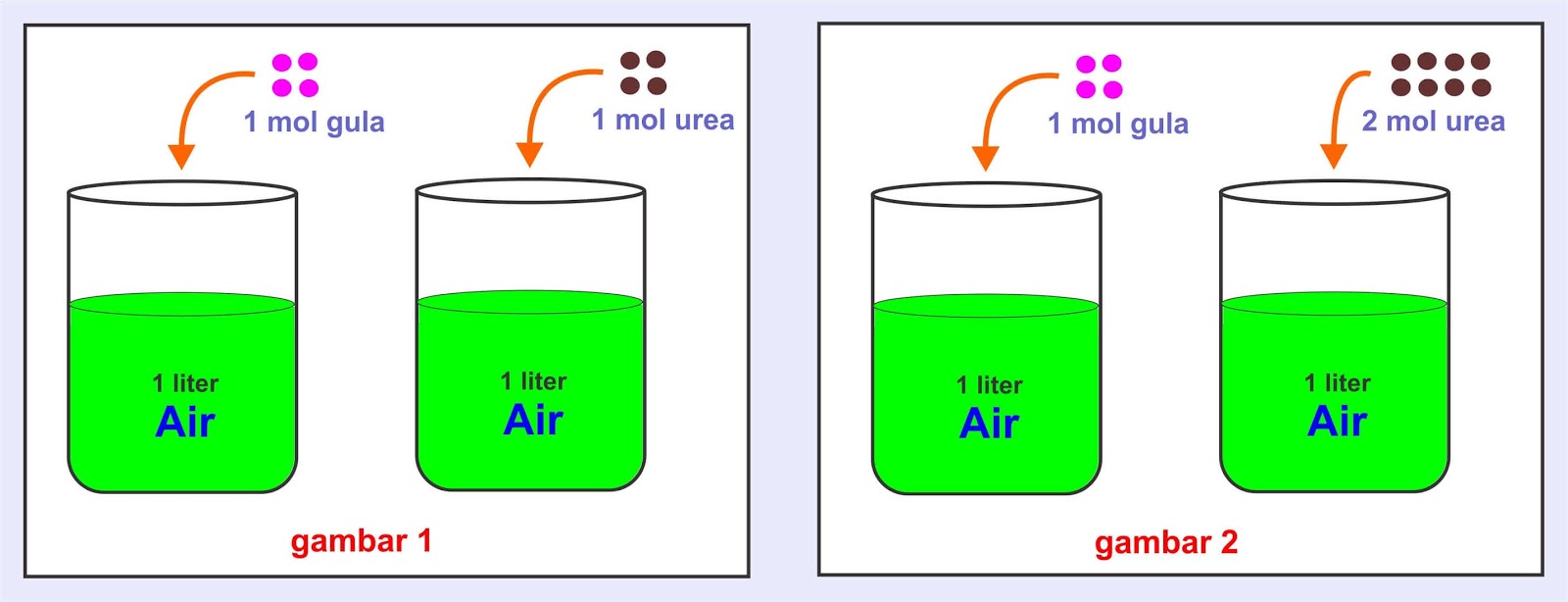
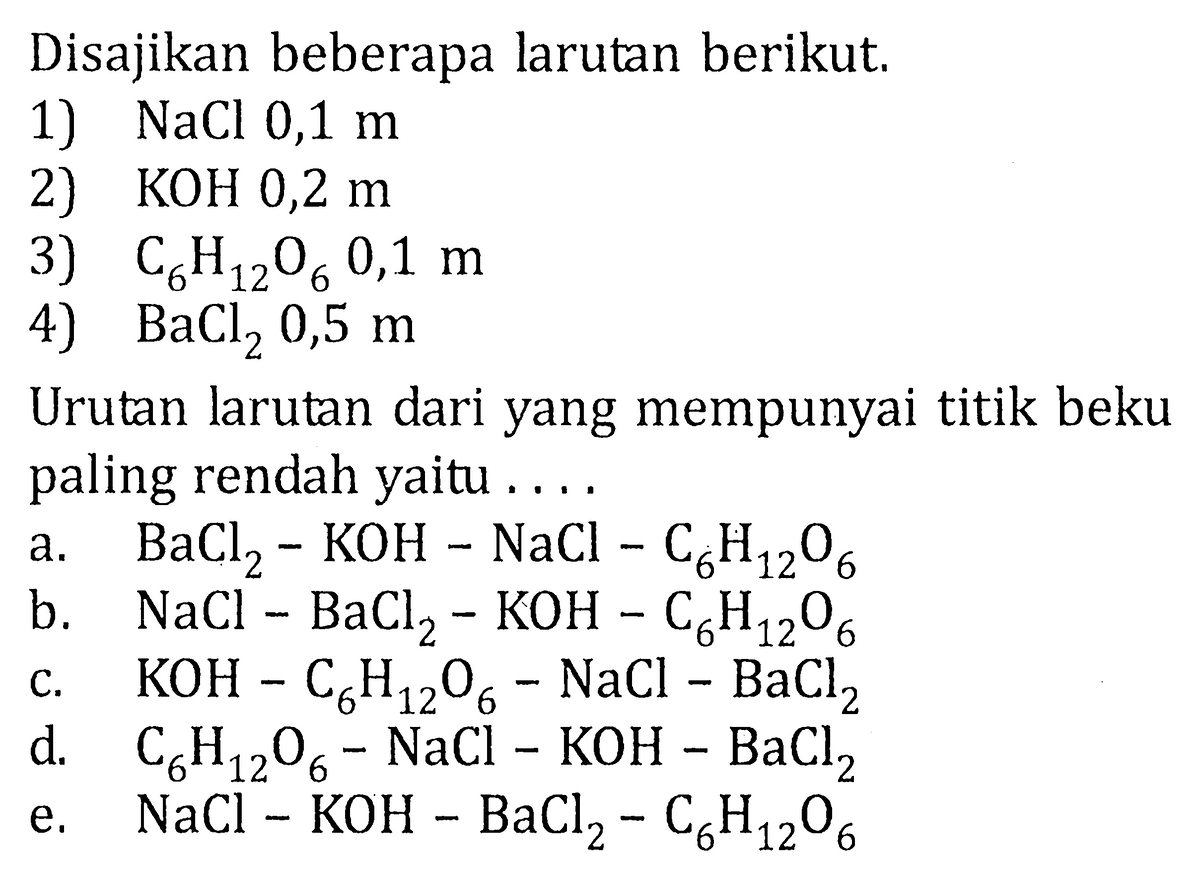
Larutan yang memiliki titik beku paling rendah adalah.
ΔTf: penurunan titik beku m: molalitas larutan Kf: konstanta penurunan titik beku (°C kg/mol) Contoh aplikasi penurunan titik beku. Contoh aplikasi penurunan titik beku adalah dengan menaburkan garam di jalanan musim dingin. Pada musim dingin, uap air dan air mudah membeku membentuk lapisan es, sehingga jalanan sulit untuk dilewati.

Kumpulan Contoh Soal Penurunan Titik Beku Kimia Kelas 12 CoLearn halaman 17
Contoh soal 1 Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku larutan. Pembahasan Pada soal ini urea sebagai zat terlarut dan air sebagai pelarut. Besaran yang diketahui sebagai berikut: gr = 2,4 gram Mr = 60 p = 50 g Kf = 1,86 °C/m T f ° = 0 °C

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Non Elektrolit) YouTube
Contoh soal sifat koligatif larutan kenaikan titik didih dan penurunan titik beku adalah sebagai berikut: Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Soal No. 1 Natrium hidroksida 1,6 gram dilarutkan dalam 500 gram air. Hitung titik didih larutan tersebut! (K b air = 0,52 0 C/m, Ar Na = 23, Ar O = 16, Ar H = 1) Pembahasan: Diketahui:

Data percobaan penurunan titik beku Larutan Konsentrasi
Soal 2. Tentukan titik beku larutan 0,025 mol suatu senyawa dalam 250 gram air, jika Kf air = 1,86º C/m!. Demikian pembahasan tentang rumus penurunan titik beku dan contoh soal yang dirangkum.
Kumpulan Contoh Soal Penurunan Titik Beku Kimia Kelas 12 CoLearn halaman 27
Dikutip dari buku Belajar Kimia Secara Menarik untuk SMA/MA Kelas XII yang ditulis oleh Das Salirawati, dkk (2007: 16), berikut adalah 4 contoh soal penurunan titik beku dan pembahasannya: 1. Tentukan titik beku larutan 0,025 mol suatu senyawa dalam 250 gram air, jika Kf air = 1,86º C/m! Jawaban: m = n/p = 0,025 mol/0,25 kg = 0,1 m Delta Tf = m .

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
4. Penambahan etilena glikol pada radiator mobil (titik beku) 15. Suatu larutan urea dalam air memiliki penurunan titik beku 0,372 °C. Jika Kb air = 0,52 °C/m dan Kf air = 1,86 °C/m maka kenaikan titik didih larutan urea tersebut adalah.. Jawaban: Hitung dulu molal zat dari data penurunan titik beku ∆Tf = m x Kf 0,372= m x 1,86 m = 0.

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
berikut KUMPULAN SOAL DAN PEMBAHASAN PENURUNAN TITIK BEKU (∆Tf) part 1 SOAL : Sebanyak 8 gram zat A dilarutkan kedalam 200 ml air. Jika diketahui tetapan penurunan titik beku air (Kf) air 1,86 /molal dan massa molar zat tersebut adalah 40 gr/mol , hitung titik beku larutan ! Dalam 200 gram air terlarut 10 gram urea CO (NH 2) 2.

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
Berikut daftarnya. Contoh Soal Penurunan Titik Beku Soal 1 Sebanyak 8 gram zat A dilarutkan kedalam 200 ml air. Jika diketahui tetapan penurunan titik beku air (Kf) air 1,86 /molal dan massa molar zat tersebut adalah 40 gr/mol , hitung titik beku larutan! Diketahui: Massa Zat A = 8 gram p Air = 200 ml Kf air= 1,86 /molal Mr zat A = 40 gr/ mol

Contoh Soal Kimia Sifat Koligatif Larutan Penurunan Titik Beku Youtube My XXX Hot Girl
Contoh soal Penurunan Titik Beku kelas 12 semester 1 beserta rumus perhitungan dan jawabannya akan disajikan berikut ini. tirto.id - Penurunan titik beku merupakan salah satu materi yang diajarkan di jenjang SMA kelas 12 semester 1. Lantas, apa yang dimaksud titik beku? Bagaimana contoh soal yang berkaitan dengan materi ini?

Soal Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
1 - 15 Soal Sifat Koligatif Larutan Pilihan Ganda dan Jawaban 1. Sifat koligatif larutan adalah sifat yang bergantung pada.. a. Jenis zat terlarut b. Jenis zat pelaut c. Jumlah zat pelarut d. Jumlah zat terlarut e. Konsentrasi larutan Jawaban : D Pembahasan