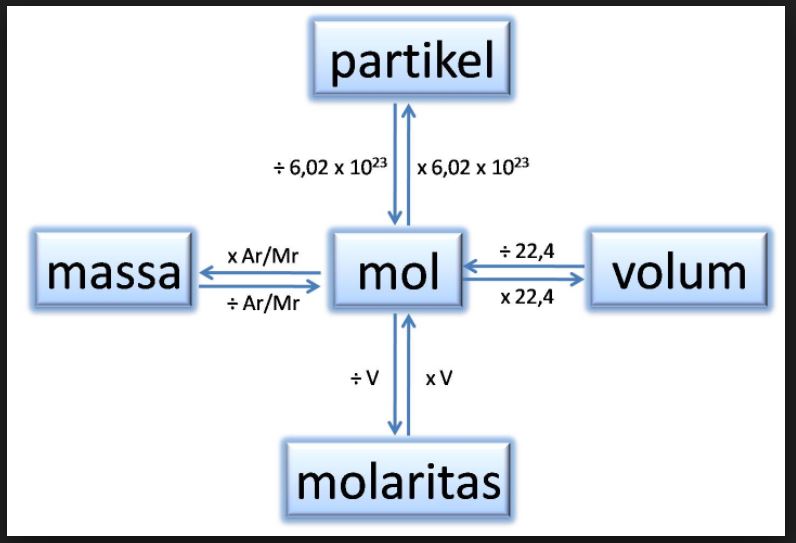
Hubungan Mol dengan Jumlah Partikel dan Massa Zat cekrisna
Hubungan Mol dengan Jumlah Partikel. massa molar = 58,44 g / 1 mol massa molar = 58,44 g/mol. Contoh Soal. Contoh soal adalah salah satu cara untuk memperdalam pemahaman mengenai konsep mol dan penerapannya dalam kimia. Berikut adalah beberapa contoh soal yang dapat membantu meningkatkan pemahaman tentang konsep mol:

Kumpulan Contoh Soal Konsep Mol dan Hubungannya dengan Jumlah Partikel, Massa Molar, dan Volume
Menurut Avogadro "Gas-gas yang volumenya sama, jika diukur pada suhu dan tekanan yang sama, akan memiliki jumlah molekul yang sama pula". Oleh karena perbandingan volume gas hidrogen, gas oksigen, dan uap air pada reaksi pembentukan uap air = 2 : 1 : 2 maka perbandingan jumlah molekul hidrogen, oksigen, dan uap air juga 2 : 1 : 2.
Materi dan Contoh Soal Hubungan Mol dengan Massa Chemistry React
Soal No. 1 1 mol besi (Fe) mengandung 6,02 x 10 23 atom. Berapakah jumlah atom besi yang terdapat dalam 2 mol besi? Pembahasan: Diketahui: 1 mol Fe = 6,02 x 10 23 atom Ditanyakan: Jumlah atom dalam 2 mol Fe..? Jawaban: 1 mol Fe = 6,02 x 10 23 atom 2 mol Fe = 2 x 6,02 x 10 23 atom = 12,04 x 10 23 atom Jadi, 2 mol Fe mengandung 12,04 x 10 23 atom.

Menghitung Jumlah mol jika diketahui Massa Molar Zat dan Massa Molekul Relatif YouTube
Soal-1. Hitunglah massa dari: a. 0,5 mol barium (Ar Ba = 137) b. 5 mol belerang (Ar S = 32) c. 2,5 mol K 2 SO 4 (Ar K = 19, S = 32, dan O = 16) d. 0,3 mol CO 2 (Ar C = 12 dan O = 16) e. 10 mol K 2 Cr 2 O 7 (Ar K = 39, Cr = 52, dan O = 16) Klik untuk melihat bahasan soal ini Soal-2. Hitunglah banyaknya mol dari: a. 8 gram H 2 (Ar H = 1)

Konsep Mol Kimia Kelas 10 • Part 1 Hubungan Mol & Massa, Jumlah Partikel, Volume Gas, Molaritas
1 x massa O = 1 x 16 = 16 gram/mol. Massa molar H 2 O = 2 + 16 = 18 gram/mol. Step 2 : Menghitung mol H 2 O. Mol = Massa Zat / massa molar. Mol H 2 O = 50 / 18 = 2.7 mol. Jika diketahui volume zat; Volume zat ini pada umumnya diterapkan dalam perhitungan mol untuk zat dengan fasa gas. Dalam keadaan STP atau Standar Temperature & Pressure, 1 mol.

Contoh Soal Molaritas Dan Pembahasannya
1 mol NaBr = 6,02 x 10^23 molekul NaBr 1 mol Cl2 = 6,02 x 10^23 molekul Cl2 1 mol Ca^2+ = 6,02 x 10^23 ion Ca^2+ Hubungan Mol dengan Massa Zat Menurut buku Explore Kimia untuk SMA/MA Kelas X karya Ika Stri Ratna, tidak hanya hubungan mol dengan jumlah praktik, ada pun hubungan mol dengan massa zat.

Contoh Soal Mol Dan Massa Molekul Fisika
Contoh soal hubungan mol dengan massa molar : 1). Diketahui Ar A r C = 12, O = 16, dan Fe = 56. Berapakah massa molar Fe dan molekul CO 2 2? Penyelesaian : *). Perbandingan massa 1 atom C-12 : massa 1 atom Fe : massa 1 molekul CO 2 2 = 12 : 56 : 44. Massa 1 mol C-12 = 12 gram, maka massa 1 mol Fe = 56 12 × 12 = 56 56 12 × 12 = 56 gram

Contoh Soal Molalitas Homecare24
m = n × Mm Keterangan: m = massa (gram) n = jumlah mol (mol) Mm = massa molar (gram/mol) Dimana Mm = Ar (untuk unsur) = Mr (untuk molekul/senyawa) Agar kalian dapat memahami bagaimana menggunakan rumus hubungan mol, massa zat dan massa molar dalam perhitungan kimia, silahkan kalian pelajari beberapa contoh soal dan pembahasannya berikut ini.

Contoh Soal Fraksi Mol dengan massa YouTube
Pembahasan materi Pengertian Mol serta Hubungan antara Mol dengan Massa Suatu Zat dari Kimia untuk SD, SMP, SMA, dan Gap Year beserta contoh soal latihan dan video pembahasan terlengkap.
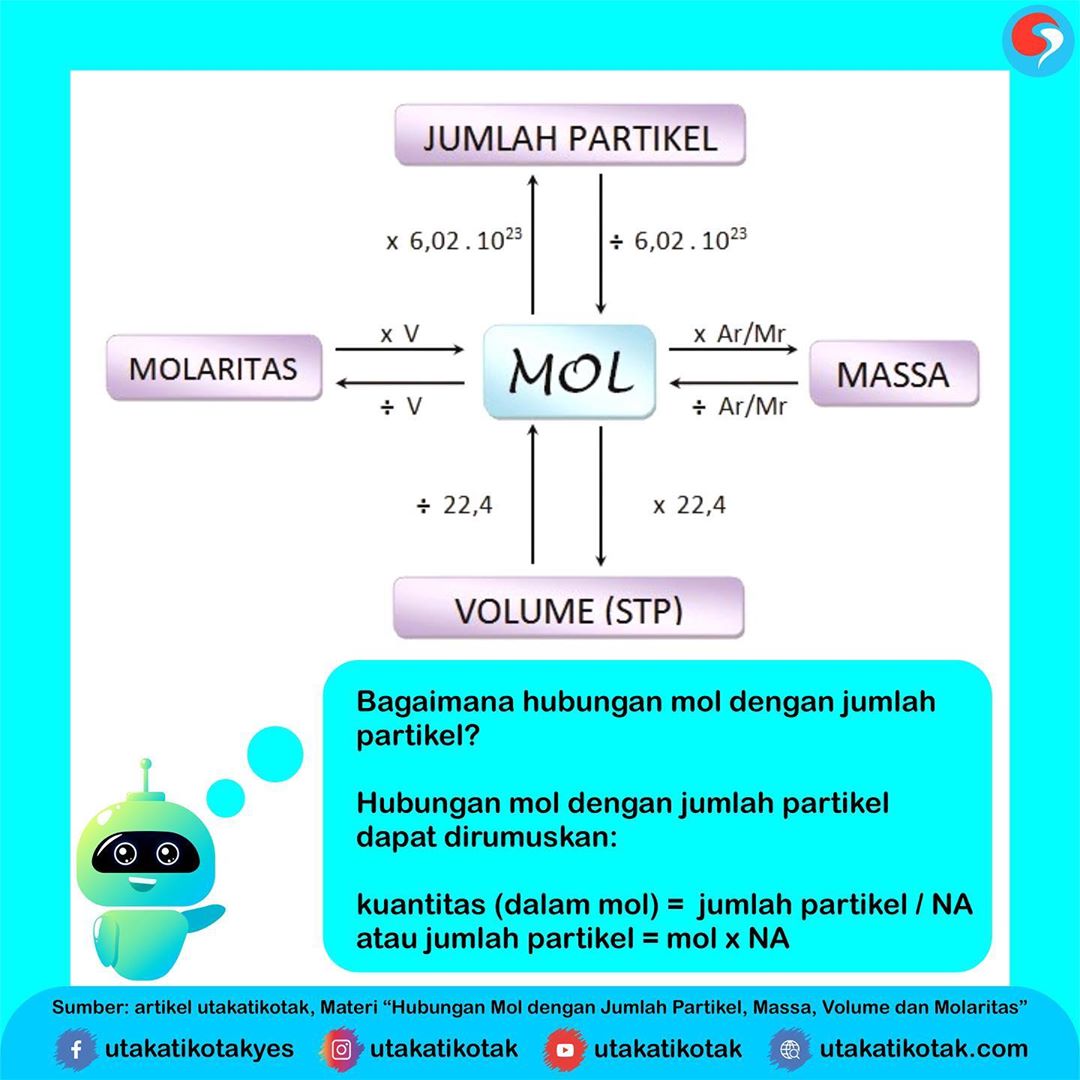
Hubungan Mol dengan Jumlah Partikel, Massa, Volume dan Molaritas
Contoh Soal Konsep Mol dan Pembahasannya Pernah nggak, Sobat Pijar membayangkan bagaimana suatu bahan kimia dibuat dengan komposisi dan kadar yang pas seperti dalam obat, kosmetik, atau produk lainnya? Dalam melakukan perhitungan yang berhubungan dengan senyawa kimia atau reaksi, mol adalah konsep yang selalu digunakan.

Contoh Soal b massa atom dan massa molekul relatif 1 YouTube
Pelajari rangkuman materi, contoh soal dan pembahasan konsep mol, kadar zat, rumus empiris dan rumus molekul, hidrat dan stoikiometri reaksi kelas 10 dilengkapi dengan video pembelajaran. Hubungan mol dengan massa/gram. Massa molar (Mm) merupakan massa suatu zat jika jumlahnya 1 mol. Jika jumlahnya bukan 1 mol massa zat dapat dihitung dengan.
Kumpulan Contoh Soal Konsep Mol dan Hubungannya dengan Jumlah Partikel, Massa Molar, dan Volume
September 7, 2021 0 Artikel ini akan membahas berbagai konsep rumus mol dengan disertai contoh soal Hola sobat Zenius! Apakah kamu tahu bahwa setiap benda dan zat tersusun oleh partikel-partikel kecil tak kasat mata seperti atom, molekul, atau ion. Namun, walaupun berukuran sangat kecil, jumlah partikel ini bisa dihitung loh!

Latihan Soal Kimia Hubungan Mol Dengan Jumlah Partikel Dan Menghitung Massa Molekul Relatif PDF
Rumus volume molar adalah di mana V adalah volume dan n adalah jumlah mol partikel. Rumus di atas dapat diubah lagi dengan mensubstitusikan nilai dan dari persamaan berikut dengan adalah massa molar.

Soal Mol Penjelasan Lengkap dan Komprehensif tentang Mol dalam Kimia
Contoh soal 1 Diketahui 0,2 mol H 2 SO 4, hitunglah: Jumlah partikel H 2 SO 4 Jumlah atom H, S, dan O Jumlah ion H + dan SO 4- Penyelesaian soal / pembahasan Jawaban nomor 1 Jumlah partikel H 2 SO 4 = mol x 6,02 x 10 23 Jumlah partikel H 2 SO 4 = 0,2 x 6,02 x 10 23 = 1,204 x 10 23 partikel Jawaban nomor 2

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Hubungan Mol dengan Massa. Hubungan antara mol dengan massa adalah sebagai berikut: n = massa/Ar. atau. n = massa/Mr. Keterangan, n = jumlah mol (mol). Contoh Soal: Hitung jumlah mol dari 4,92 L gas nitrogen (N 2) pada suhu 27 0 C dan tekan 1 atm! Pembahasan: Diketahui: V = 4,92 L. T = 27 0 C = 273 + 27 = 300 K.

Stoikiometri (Soal 36 Konsep Mol (Hubungan Mol dengan Massa dan Volume)) YouTube
contoh soal ; 1). Tentukan jumlah mol senyawa NaCl 106 gram jika diketahui Ar Na = 23 dan Ar Cl = 35 ! Jawaban ; mol = massa / Mr = 106/58 =1,8 mol 2). Tentukan massa dari 0,1 mol CO (NH 2) 2 , jika diketahui Ar C = 12 , Ar O =16 , dan Ar N = 14 dan Ar H = 1 Jawaban ; massa = mol × Ar atau Mr = 0,1 × 60 = 6 gram 4.