
Unsur Yang Mempunyai Keelektronegatifan Terbesar Adalah Berbagai Unsur
Keelektronegatifan adalah sifat periodik, yang artinya bervariasi dengan cara yang dapat diprediksi di seluruh tabel periodik unsur. Ini terjadi karena muatan inti efektif juga merupakan sifat periodik. Seperti dijelaskan di atas, semakin besar muatan inti efektif, semakin besar keelektronegatifan suatu atom, karena inti atom dapat menarik.

Rangkuman Dan Latihan Soal Konfigurasi Elektron Periode Dan Golongan My XXX Hot Girl
Video ini membahas pelajaran kimia kelas 10 kurikulum 2013 mengenai atom dan sistem periodik. Topik kali ini adalah mencari unsur mana yang memiliki keelekt.

Sifat Keperiodikan Unsur ( Part 2) Afinitas Elektron, Keelektronegatifan dan Sifat Logam
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron ke dalam ikatannya ketika atomatom tersebut membentuk ikatan. Keelektronegatifan diukur dengan menggunakan skala Pauling yang besarnya antara 0,7 sampai 4. Yang mana, unsur yang mempunyai harga keelektronegatifan besar, cenderung menerima elektron dan akan membentuk ion negatif.

Keelektronegatifan Ujian
Pembahasan Soal #3: Senyawa yang atom-atamnya memiliki perbedaan keelektronegatifan terbesar bersifat lebih ionik, sebaliknya yang memiliki perbedaan keelektronegatifan terkecil ia akan dominan karakter kovalennya. ∆ keelektronegatifan AB → |4,0 - 3,3| = 0,7. ∆ keelektronegatifan AD → |4,0 - 1,3| = 2,7.

Diketahui data keelektronegatifan unsurunsur sebagai ber...
Skala Pauling merupakan skala yang digunakan untuk menentukan nilai keelektronegatifan pada tabel periodik. 3. Bagaimana cara menghitung keelektronegatifan? Untuk menghitung keelektronegatifan, kamu dapat menggunakan tabel periodik atau rumus: keelektronegatifan = 0,5 x (nilai elektronegativitas unsur A + nilai elektronegativitas unsur B). 4.

keelektronegatifan yang terbesar terletak pada A. Golongan VIIA paling atas YouTube
Jadi keelektronegatifan terbesar berada pada golongan VIIA. 1. Membuat konfigurasi elektron masing-masing unsur. 2. Menentukan unsur yang paling elektronegatif. Semakin ke atas dan semakin ke kanan (golongan VIIA) letak suatu unsur dalam tabel periodik maka keelektronegatifan semakin besar.

Jelaskan Energi Ionisasi dan Keelektronegatifan? Fisika Kimia
Ilustrasi Interaksi Atom Dengan Nilai Keelektronegatifan Rendah dan Tinggi Saat Berikatan, Gambar Oleh I.N.G Wardana. Nah, begitulah kira-kira bagaimana cara Linus Pauling berfikir pada saat akan menentukan rumus besar atau kecilnya nilai keelektronegatifan atom pada tabel periodik.

Diketahui unsur 9 F , 17 Cl , 35 Br dan 53 I . Urutkan da...
Sama halnya dengan jari-jari atom, sifat keperiodikan unsur yang satu ini juga memiliki kecenderungan sebagai berikut: Dalam satu golongan dari atas ke bawah, energi ionisasi suatu unsur semakin kecil dikarenakan jari-jari atom bertambah besar, sehingga daya tarik inti terhadap elektron terluar semakin lemah dan energi ionisasi berkurang.
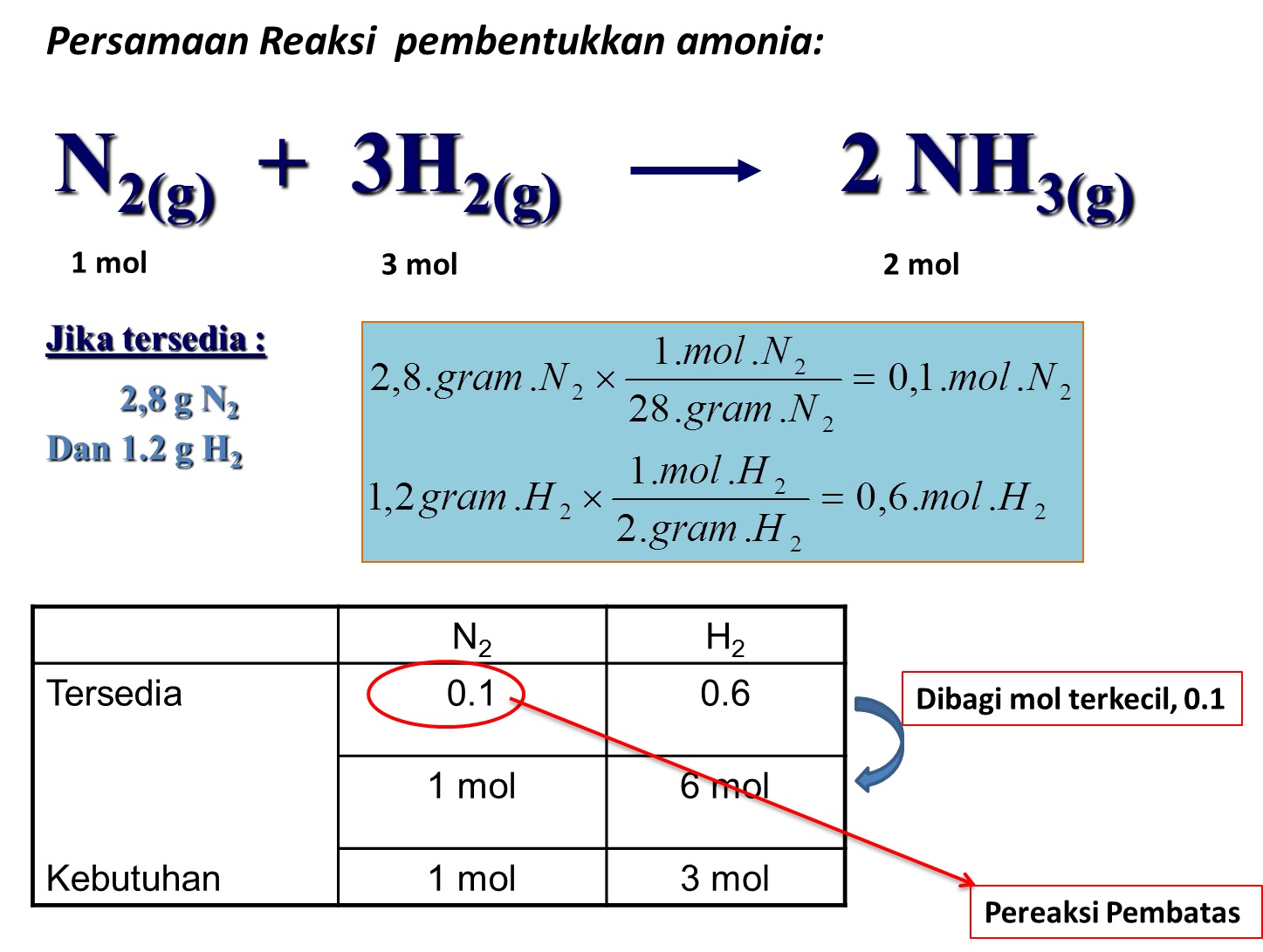
Cara Menentukan Pereaksi Pembatas Dalam Reaksi Kimia My XXX Hot Girl
Sedangkan, keelektronegatifan adalah kemampuan atom menarik elektron. Artinya, energi ionisasi dan keelektronegatifan adalah kebalikan. Dilansir dari Thought Co, atom dengan energi ionisasi yang rendah memiliki keelektronegatifan yang rendah juga karena inti atomnya tidak memberikan gaya tarik menarik yang kuat terhadap elektron.

Keelektronegatifan Terbesar YouTube
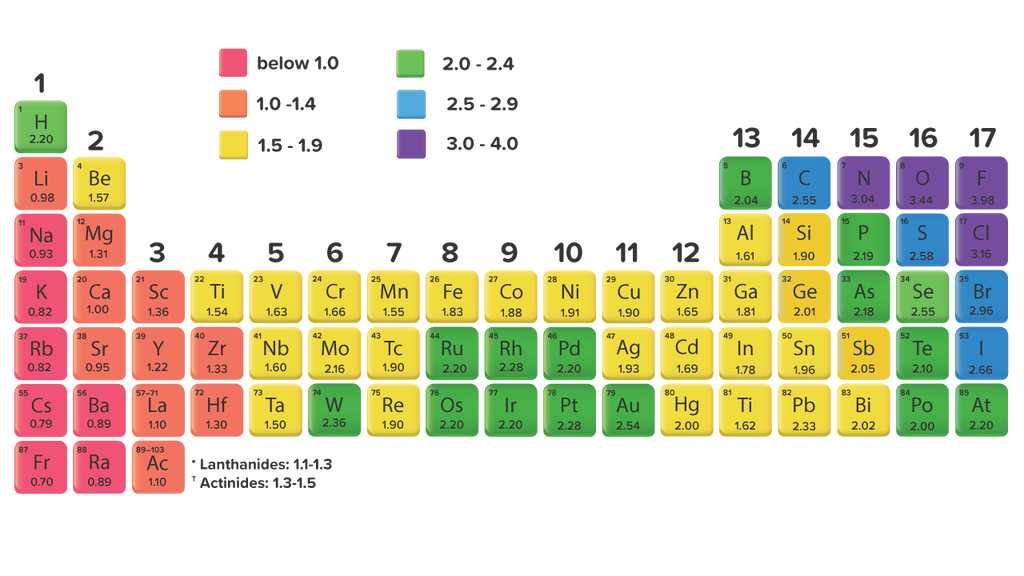
Keelektronegatifan adalah salah satu tren tabel periodik. Cara umum untuk mengukur keelektronegatifan adalah dengan menggunakan skala Pauling. Linus Pauling adalah seorang ilmuwan Amerika yang memenangkan Hadiah Nobel untukkimia dan perdamaian. Skala keelektronegatifan Pauling dapat dilihat pada Gambar 1 juga. Gambar 1.

Suatu Unsur X Dengan Nomor Atom Mempunyai Jumlah Orbital Seputar Nomor My XXX Hot Girl
Dengan demikian, elektron-elektron akan tertarik mendekati klorida dan menjauhi natrium. 3. Gunakan tabel elektronegativitas sebagai referensi. Tabel elektronegativitas unsur memiliki unsur yang disusun tepat seperti dalam tabel periodik, kecuali bahwa setiap atom dilabeli dengan elektronegativitasnya masing-masing.

latihan soal UN keelektronegatifan dalam Satu golongan kimia SMA YouTube
Adapun, unsur dengan keelektronegatifan terbesar adalah fluor dan unsur yang paling rendah keelektronegatifitasnnya adalah fransium. Baca juga: Sifat Periodik Unsur. Jenis ikatan kimia yang dihasilkan. Keelektronegatifan dua atom akan menentukan jenis ikatan kimia yang dihasilkan.

Keelektronegatifan / Elektronegatifitas Suatu Unsur Adalah Sifat Yang Menyatakan tujuan dari
Avogadro dan ahli kimia lainnya mempelajari elektronegativitas sebelum secara resmi dinamai oleh Jöns Jacob Berzelius pada tahun 1811. Pada tahun 1932, Linus Pauling mengusulkan skala elektronegativitas berdasarkan energi ikatan . Nilai keelektronegatifan pada skala Pauling adalah bilangan tak berdimensi yang berkisar antara 0,7 hingga 3,98.
Unsur yang memiliki keeletronegatifan paling tingg...
Cara mudah menentukan urutan jari jari atom, keelektronegatifan, energi ionisasi dan Afinitas elektron di Sistem Periodik Unsur.Jika menemui soal seperti ini.

Trik Super Kilat Memahami Keelektronegatifan
Avogadro dan ahli kimia lain mengkaji keelektronegatifan sebelum ia dinamakan secara rasmi oleh Jöns Jacob Berzelius pada tahun 1811. Pada tahun 1932, Linus Pauling mencadangkan skala keelektronegatifan berdasarkan tenaga ikatan . Nilai keelektronegatifan pada skala Pauling ialah nombor tanpa dimensi yang berjalan dari kira-kira 0.7 hingga 3.98.

Pembahasan soal Sifat Keperiodikan Unsur (Keelektronegatifan terbesar dan terkecil) YouTube
Cara Menghitung Energi Ionisasi Cara menentukan energi ionisasi dapat dilakukan menggunakan Model Atom Bohr. Model tersebut akan memprediksi beberapa jalur bagi elektron pada saat mengelilingi inti yang mengandung proton dan neutron. Rumus energi ionisasi dengan model Bohr dapat dituliskan sebagai berikut: En = - 2π² Me⁴/4πϵ₀ Z²/N²